
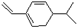
 ,该烃以物质的量之比为1:1与Br2加成时,所得产物有( )
,该烃以物质的量之比为1:1与Br2加成时,所得产物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在pH=11的溶液中,K+、Cl-、HSO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、Fe2+、K+可以大量共存 | |
| C. | 常温下,由0.1 mol•L-1一元碱BOH溶液的pH=10,可知BOH溶液中存在BOH?B++OH- | |
| D. | 常温下,由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O=HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7gH2O2中含有的电子总数为0.9NA | |
| B. | 92g NO2和N2O4的混合气中含有的氮原子数为2NA | |
| C. | 标准状况下,28 g CO与22.4 L O2所含原子数相等 | |
| D. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
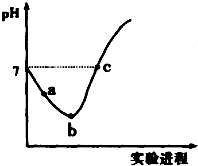 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
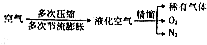
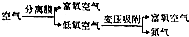
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com