
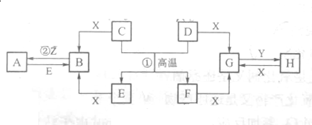
 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去). ,故答案为:
,故答案为: ;
;
| ||
 ,故答案为:
,故答案为: .
.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
| A、2.8g | B、4.4g |
| C、10.6g | D、1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
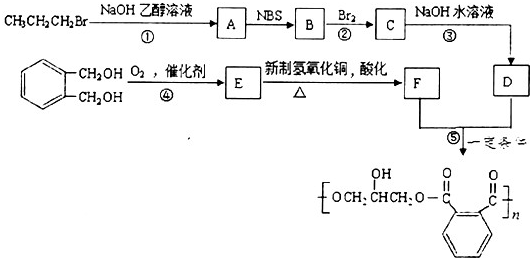
| NBS |
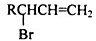
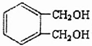 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
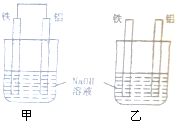 将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.
将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.| A、两烧杯中铝片表面均有气泡产生 |
| B、甲中铝片是正极,乙中铁片是负极 |
| C、两烧杯中溶液的pH均增大 |
| D、产生气泡的速度甲比乙快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
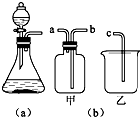 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com