
分析 (1)等物质的量的HA和NaOH恰好反应生成NaA,因为c(Na+)>c(A-),根据电荷守恒知c(H+)<c(OH-),说明A-在溶液中部分水解;
(2)任何电解质溶液中都存在电荷守恒,根据物料守恒计算c(HA)+c(A-);
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(4)25℃时,如果取0.2mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaA和HA,测得混合溶液的pH<7,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度;
(5)A.若反应后溶液呈中性,则溶液中存在c(H+)=c(OH-)=10-7 mol•L-1;
B.若V1=V2,要根据酸碱浓度相对大小确定溶液酸碱性;
C.若反应后溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.
解答 解:(1)等物质的量的HA和NaOH恰好反应生成NaA,因为c(Na+)>c(A-),根据电荷守恒知c(H+)<c(OH-),证明NaA为强碱弱酸盐,A-在溶液中部分水解:A-+H2O?HA-+OH-,导致溶液呈碱性,
故答案为:<; A-+H2O?HA-+OH-;
(2)任何电解质溶液中都存在电荷守恒,二者混合时溶液体积增大一倍,溶液浓度降为原来的一半,根据物料守恒得c(HA)+c(A-)=0.1 mol•L-1,
故答案为:0.1 mol•L-1;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,该溶液中含有弱离子的盐,所以促进水电离,HA抑制水电离,则合溶液中由水电离出的c(OH-)>0.2mol•L-1 HA溶液中由水电离出的c(H+),
故答案为:>;
(4)25℃时,如果取0.2mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaA和HA,测得混合溶液的pH<7,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,
故答案为:>;
(5)A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=2×10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,故A正确;
B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,题目难度中等,涉及盐类水解、弱电解质的电离,明确溶液中溶质及其性质是解本题关键,难点是(5)题酸碱体积判断,采用逆向思维方法分析解答.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:解答题
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
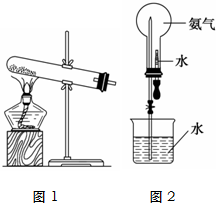 氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:
氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的摩尔体积约为22.4L•mol-1 | |
| B. | 在标准状况下,1mol任何物质所占的体积都约为22.4L | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ 不与I-发生反应 | |
| B. | F-使I-的还原性减弱 | |
| C. | Fe3+ 与F-结合成不与I-反应的物质 | |
| D. | Fe3+ 被F-还原为Fe2+使溶液中不再存在Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com