
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、△H1=△H2 |
| B、△H1>△H2 |
| C、△H1<△H2 |
| D、金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
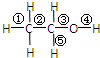 乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.
乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都呈透明的红褐色 |
| B、分散质颗粒直径相同 |
| C、都比较稳定,密封保存一段时间都不会产生沉淀 |
| D、都能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸溶于水的电离方程式:H2CO3?CO32-+2H+ |
| B、标准状况下将112mL Cl2通入10 mL 1 mol?L-1 FeBr2溶液的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C、用单线桥表示浓盐酸和KClO3反应的电子转移的数目与方向: |
D、过氧化钠的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:漂白粉溶液 Y:二氧化硫 |
| B、X:硝酸钡溶液 Y:二氧化硫 |
| C、X:氯化铝溶液 Y:氨气 |
| D、X:偏铝酸钠溶液 Y:二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16% | B、25% |
| C、50% | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com