
ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ�⣺BaSO4(s)  Ba2��(aq)��SO42-
(aq)��Ksp��c(Ba2��)��c(SO42-)�������ܽ�ƽ��������ͼ��ʾ������˵����ȷ����
Ba2��(aq)��SO42-
(aq)��Ksp��c(Ba2��)��c(SO42-)�������ܽ�ƽ��������ͼ��ʾ������˵����ȷ����
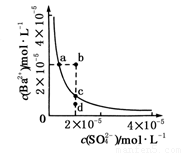
A��b��ʱc(Ba2��)��c(SO42-)С��Ksp
B��a���Ӧ��Ksp����c���Ӧ��Ksp
C����ˮϡ�Ϳ���ʹ��Һ��b��䵽c��
D������������Na2SO4������ʹ��Һ��a��䵽c��
B
��������
�����������ͼ�е���ƽ�����ߣ����ϵ�����㶼��ƽ��״̬��b��d����ƽ��״̬��A����ͼ��֪b���c(Ba2��)��c(SO42-)����Ksp ����A��ȷ��B��ac�������ϣ�����Kspֵ��ȣ���B��ȷ��C����ˮϡ����Һʱc��SO42-����c��Ba2+�������ͣ���C����D������BaSO4(s)  Ba2��(aq)��SO42-
(aq)����Na2SO4��Ba2+Ũ�Ƚ��ͣ�SO42-Ũ�����ߣ��������Na2SO4����ʱ����ʹ��Һ��a���Ϊc�㡣
Ba2��(aq)��SO42-
(aq)����Na2SO4��Ba2+Ũ�Ƚ��ͣ�SO42-Ũ�����ߣ��������Na2SO4����ʱ����ʹ��Һ��a���Ϊc�㡣
���㣺���ݵ���ʵ��ܽ�ƽ�⼰����ת���ı���


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2008?ɽ����ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ�������
��2008?ɽ����ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
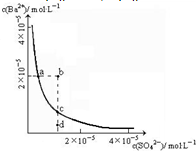 BaSO4��ˮ�д��ڳ����ܽ�ƽ��BaSO4��s���TBa2+��aq��+SO42-��aq�����ܶȻ�����Ksp=c��Ba2+��?c��SO42-����
BaSO4��ˮ�д��ڳ����ܽ�ƽ��BaSO4��s���TBa2+��aq��+SO42-��aq�����ܶȻ�����Ksp=c��Ba2+��?c��SO42-�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
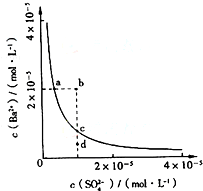 ��2013?¹����ģ�⣩ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ�������
��2013?¹����ģ�⣩ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ��H��kJ/mol�� |
| H2��g�� | -285.8 |
| CO��g�� | -283.0 |
| CH4��g�� | -890.3 |
| 4n |
| 4n-2na |
| 4n |
| 4n-2na |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com