
| A. | LiCl | B. | NaCl | C. | KCl | D. | KBr |
分析 两离子间距=阳离子半径+阴离子半径.而离子的电子层数越多,离子半径越大;当电子层数相同时,核电荷数越多,半径越小;以此来解答.
解答 解:在LiCl、NaCl、KCl三种物质中,阴离子相同,故离子间的距离取却于阳离子,而Li+的核外有1个电子层,Na+的核外有2个电子层,K+的核外有3个电子层,故三种物质中KCl中离子间距最大;而KCl和KBr的阳离子相同.阴离子不同,故离子间距大小取决于阴离子,而Br-的核外有4个电子层,故半径大于Cl-,则KBr中的离子间距大于KCl中的离子间距,故选D.
点评 本题考查了依托离子间距的大小比较来考查了离子半径的大小比较,应注意的是比较离子半径时,先考虑电子层数,然后考虑核电荷数,最后考虑电子数.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 227.2kJ•mol-1 | B. | -227.2kJ•mol-1 | C. | 798.8kJ•mol-1 | D. | -798.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 测定常温时的等浓度的HCOONa溶液、CH3COONa溶液的pH | pH(HCOONa)<pH(CH3COONa) | 弱酸的酸性:HCOOH>CH3COOH |
| B | 向0.5ml 2mol/L的NaOH溶液中加入1ml 1mol/L的CuSO4溶液,振荡后再加入0.5ml有机物X,加热 | 未出现砖红色沉淀 | 说明X中不含有醛基 |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
| D | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氧化铝沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | a gO2和O3的混合气体中含有的分子总数为$\frac{a{N}_{A}}{32}$ | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol•L-1,则Na+个数为2NA | |
| D. | 78g过氧化钠晶体中,含2NA个阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | HNO3 | C. | Cl2 | D. | MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E分别是铁或铁的化合物,其中D是一种红褐色沉淀,其相互反应关系如图所示:
A、B、C、D、E分别是铁或铁的化合物,其中D是一种红褐色沉淀,其相互反应关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 操作和现象(或数据) | 结论 | |
| A | 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,有白色沉淀生成,再加入2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 温度相同时,Fe(OH)3溶解度小于Mg(OH)2 |
| B | 向含有少量氢氧化镁沉淀的试管中滴入NH4Cl溶液,沉淀逐渐溶解,并有刺激性的气味气体产生 | 对应的离子反应方程式为NH4++OH-═NH3↑+H2O- |
| C | 20克Ba(OH)2•8H2O粉末和10克NH4Cl粉末混合后玻璃棒迅速搅拌,可以闻到刺激性气味的气体 | 该反应为放热反应,促使氨水分解生成NH3 |
| D | 常温下,将NaAlO2溶液和NaHCO3溶液混合产生大量白色沉淀 | 说明AlO2-结合H+能力大于CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
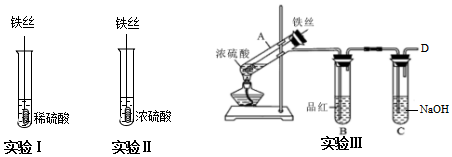
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com