
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
分析 (1)根据盖斯定律,已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数,进行相应的加减.注意消除中间产物CH30H、H2O.
催化反应室中温度小于830℃,升高温度反应③平衡向正反应移动,平衡常数增大.
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=$\frac{△c}{△t}$计算v(CO);
(3)①K=生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算,依据浓度商和平衡常数比较判断反应进行的方向;
②根据平衡常数计算平衡浓度,结合反应速率之比等于化学计量数之比计算v(CH3OH);
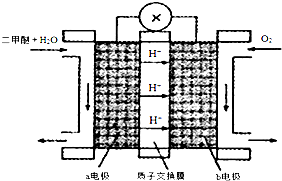
(4)①由图可知,a极通入甲醚,a极是负极发生氧化反应,b极通入氧气,b极为正极,发生还原反应,正极电解反应式为3O2+12H++12e-=6H2O,总的电极反应式为CH3OCH3+3O2=2CO2+3H2O,总的电极反应式减去正极反应式可得负极电极反应式;
②先计算出二甲醚的物质的量,计算出转移电子的物质的量,再计算转移电量.
解答 解:(1)已知①CO( g)+2H2(g)?CH3OH( g)△H1=-91kJ•mol-1,
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.催化反应室中温度小于830℃,升高温度反应③平衡向正反应移动,平衡常数增大;
故答案为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1;>;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),故答案为:0.1mol/(L•min);
(3)①该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,将所给浓度带入平衡常数表达式:$\frac{0.5×0.5}{0.6{4}^{2}}$=0.61<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol•L-1):0.64 0.5 0.5
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.64-2x 0.5+x 0.5+x
K=$\frac{(0.5+x)^{2}}{(0.64-2x)^{2}}$=400,解得x=0.3mol/L,
故平衡时c(CH3OH)=0.64mol/L-0.3mol/L×2=0.04mol/L,
故答案为:0.04;
(4)①由图可知,a极通入甲醚,a极是负极发生氧化反应,b极通入氧气,b极为正极,发生还原反应,正极电解反应式为3O2+12H++12e-=6H2O,总的电极反应式为CH3OCH3+3O2=2CO2+3H2O,总的电极反应式减去正极反应式可得负极电极反应式,故负极电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;
②23g二甲醚的物质的量为$\frac{23g}{46g/mol}$=0.5mol,电解过程中转移电子的物质的量为0.5mol×12=6mol,转移电子的电量为0.5mol×12×1.6×10-19C×6.02×1023 mol-1,故答案为:0.5mol×12×1.6×10-19C×6.02×1023 mol-1.
点评 题目综合性较大,涉及盖斯定律、热化学方程式书写、化学反应速率、化学平衡计算、平衡常数、原电池等内容,难度中等,注意平衡常数的有关计算,成为近几年高考的热点,注意(4)中利用两极电极反应式加合为总电极反应式书写电极反应式.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2的反应 | B. | 铝片与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O和NH4Cl的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-) | |
| B. | 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com