
![]() 如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。
(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年江苏省东台市唐洋中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。
① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |

查看答案和解析>>
科目:高中化学 来源:2014届江苏省东台市高二下学期期中考试化学试卷(解析版) 题型:填空题
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。

① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
② 如右图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲 乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲 乙。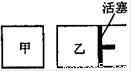
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修4 2.1化学反应速率练习卷(解析版) 题型:填空题
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
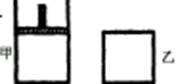
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省成都市高三第二次诊断性考试模拟试卷(理综)化学部分 题型:填空题
Ⅰ)⑴已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=-483.6kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H= ▲ 。
2NH3(g)的△H= ▲ 。
⑵在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ▲ ;
②达到平衡时NH3的体积分数为 ▲ 。
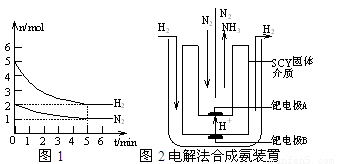
⑶近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 ▲ 。
Ⅱ)甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)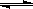 CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20molCH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。

(1)温度不变,缩小体积,增大压强,①的反应速率 ▲ (填“增大”、“减小”或“不变”),平衡向 ▲ 方向移动。
(2)反应①的△H1 ▲ 0(填“<”、“=”或“>”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com