
����Ŀ��I.��1���������з�Ӧ��2SO2 + O2 ![]() 2SO3 �� ���2min��SO2��Ũ����8 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�������ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v(O2)Ϊ0.5mol/(L��min)����ô2minʱSO2��Ũ��Ϊ_____________��
2SO3 �� ���2min��SO2��Ũ����8 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�������ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v(O2)Ϊ0.5mol/(L��min)����ô2minʱSO2��Ũ��Ϊ_____________��
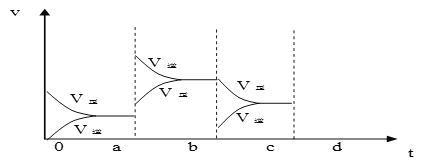
��2����ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2![]() 2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������____________��b c�����иı������������____________�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c-d��__________.
2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������____________��b c�����иı������������____________�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c-d��__________.
��3���������е���ƽ�⣺NH3��H2O![]() NH4+ + OH -����ʹc(NH4+)����Ĵ�ʩ�ǣ�_________
NH4+ + OH -����ʹc(NH4+)����Ĵ�ʩ�ǣ�_________
�������¶� �ڼӰ��� ��ˮ �� NH4Cl��Һ ��NaOH��Һ ������������
II.��һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��____________��
��2���÷�ӦΪ____________��Ӧ��ѡ�����ȡ����ȣ���
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��3c��CO2����c��H2����5c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ____________�棻
��4��830��ʱ����������м���1LCO2��1LH2��ƽ��ʱCO2�����������____________��
���𰸡�3mol/(L��min) 1.5mol/(L��min) 2mol/L �����¶ȣ� ����SO3Ũ��  �٢ڢܢ� K=C(CO)��C(H2O)/C(CO2)��C(H2) ���� 700 25%
�٢ڢܢ� K=C(CO)��C(H2O)/C(CO2)��C(H2) ���� 700 25%
��������
I.��1����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊv=![]() =
=![]() =3mol/��L��min����v��O2��=
=3mol/��L��min����v��O2��=![]() v��SO2��=1.5mol/��L��min����ͬһ��ѧ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ����Զ�������ķ�Ӧ������������2��Ϊ1mol/��L��min����2min�ڶ�������Ũ�ȵı仯��Ϊ1mol/��L��min����2min=2mol/L������������ƽ��Ũ��=4mol/L-2mol/L=2mol/L��
v��SO2��=1.5mol/��L��min����ͬһ��ѧ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ����Զ�������ķ�Ӧ������������2��Ϊ1mol/��L��min����2min�ڶ�������Ũ�ȵı仯��Ϊ1mol/��L��min����2min=2mol/L������������ƽ��Ũ��=4mol/L-2mol/L=2mol/L��
��2��aʱ�淴Ӧ���ʴ�������Ӧ���ʣ������淴Ӧ���ʶ�����˵��ƽ��Ӧ���淴Ӧ�����ƶ����÷�Ӧ������Ӧ���ȣ�ӦΪ�����¶ȵĽ����bʱ����Ӧ���ʲ��䣬�淴Ӧ���ʼ�С���ڴ˻�������С��ӦΪ��С�������ԭ��������ѹǿʱ��ƽ��������Ӧ�����ƶ��������淴Ӧ���ʶ�����������Ӧ���ʴ����淴Ӧ���ʣ�ͼ��ӦΪ ��
��
��3���������е���ƽ�⣺NH3��H2O![]() NH4+ +OH -��
NH4+ +OH -��
�������¶ȣ�����ƽ�������ƶ���c(NH4+)������ȷ��
�ڼӰ�������ˮ��Ũ��������ƽ�������ƶ���c(NH4+)������ȷ��
�ۼ�ˮ��ƽ�������ƶ�����c(NH3��H2O)��c(NH4+)��c(OH -)����С���ʴ���
�ܼ���NH4Cl��Һ��ƽ�������ƶ�����笠�����Ũ��������ȷ��
�ݼ���NaOH��Һ������������Ũ������ƽ�������ƶ���c(NH4+)��С���ʴ���
�������������ᣬ���������������к����������ӣ�����������Ũ�ȼ��٣�ƽ�������ƶ���c(NH4+)������ȷ��
��Ϊ�٢ڢܢޣ�
II.��1����ӦCO2��g����H2��g��![]() CO��g����H2O��g����ƽ�ⳣ��������������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ���K=
CO��g����H2O��g����ƽ�ⳣ��������������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ���K=![]() ��
��
��2��ͼ�����ݷ�����ƽ�ⳣ�����¶���������˵���¶�����ƽ��������У�����Ӧ�����ȷ�Ӧ��
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��3c��CO2����c��H2����5c��CO����c��H2O������K=![]() =
=![]() =0.6�������֪����ʱ���¶�Ϊ700����
=0.6�������֪����ʱ���¶�Ϊ700����
��4��830��ʱ��K=1��
��������м���1L CO2��1L H2����ƽ��ʱת����xL��
��K=![]() =
=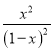 =1��
=1��
x=0.5���ַ�Ӧǰ���������������䣬��Ϊ2L����ƽ��ʱCO2���������Ϊ![]() =25%��
=25%��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����___(�����)��
�ٽ�1 mol NaCl�ܽ���1 Lˮ�У��ɵ�1 mol��L��1NaCl����Һ
�ڽ�11.2 L HCl����ͨ��ˮ���0.5 L��Һ���õ�1 mol��L��1������
��1 L 10 mol��L��1��������9 Lˮ��ϣ��õ�1 mol��L��1������
�ܽ�0.4 g NaOH�ܽ�ˮ���γ�100 mL��Һ������ȡ��10 mL����ȡ��Һ���ʵ���Ũ��Ϊ0.1 mol��L��1(��������Һ����ı仯)
�ݽ�1 mol Na2O����ˮ���1 L��Һ���������ʵ����ʵ���Ũ��Ϊ1 mol��L��1(��������Һ����ı仯)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���軯��ұ������в��������ĺ����ˮ(��Ҫ����CN-��Cu(CN)32-��SO32-������)������ͨ����������������������д�����ijС��ͬѧ�Ըù��̽���ģ�⡣
����1����Һ�д���ƽ��Cu(CN)32-![]() CuCN��+2CN-
CuCN��+2CN-
����2��2Cu2++4CN-=2CuCN ��+(CN)2
(1)����CuCl2��Һ�Ժ����ˮ���г���������������Һ������(CNT)��������(CN-)��ȥ������CuCl2�������仯������ͼ��ʾ��

CuCl2������������(CNT)��������(CN-)ȥ���ʵ�Ӱ��
������ƽ���ƶ�ԭ�����ͣ�����CuCl2����������(3.0 g��ǰ)����Һ������(CNT)��������(CN-)��ȥ���ʱ仯����_________��
����SO32-�������£�CuCl2�ɽ���ˮ�е�Cu(CN)32-ֱ��ת��ΪCuCN�������ù��̵����ӷ���ʽΪ__________��
(2)�����ѵ缫�Գ�����ķ�Һ�в�����CN-�����ӽ�һ�����е�������һ���ĵ�ѹ�£��������۲쵽���Ե����ݣ������飬����Ҫ�ɷ�ΪN2��CO2����С��ͬѧʵ��ʱ���֣�����(1)�г�����CuCl2��ΪCuSO4����ⷨ��������ȥ��CN-��
�����й��ڵ��������������ˮ��˵����ȷ����__________��
A���������۲쵽��������Ҫ������ CN-�������ŵ������
B��������֮��С��ͬѧ���������ܻ��ս���ͭ
C����ⷨ���������У�Cu(CN)32-������Ǩ��
��CN-�а���̼����������������̼Ԫ�صĻ��ϼ�Ϊ ______��
�����û�ѧ�������͵�������Cl-�����ã�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɫ������ֲ����������������ϳ���Ҫ��ǰ�����ʣ��ձ�����ڸߵ�ֲ���С�������ɫ����Ϊ��ɫ����ɫ�ᾧ������ˮ������������������ƣ���ṹ��ͼ��ʾ�����й���ɫ�����˵������ȷ����
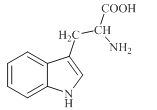
A.ɫ����ķ���ʽΪC11H12N2O2
B.ɫ�����ܷ���ȡ�����ӳɡ��������кͷ�Ӧ
C.ɫ��������ˮ��������������Һ����Ϊ�����ᡢ��ܷ�Ӧ������
D.��ɫ������ʰ��ᣨNH2CH2COOH����ϣ���һ�������������γ����ֶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֧�����ȵ��Թֱܷ������ͬ״̬�����壺�ٰ������������Ϊ4��l��NO2��O2���壻��NO2���壻�����Ƿֱ�����ʢ������ˮ��ˮ���У�Һ��㶨��(�����Թ���Һ�岻��ɢ)�������н�����ȷ����( )
A.�ٺ͢��Թ�����Һ������ȣ��������ʵ���Ũ��Ҳ�����
B.��Ϊ���Ƕ�������ˮ������Һ�涼�������Թܶ���
C.��֧�Թ��У��Թܢ�����Һ�����ʵ����ʵ���Ũ����С
D.�Թܢں��Թܢ�����Һ�����ʵ����ʵ���Ũ��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����H2��g��+![]() O2��g��= H2O��l�� ��H= ��285.8 kJ/mol
O2��g��= H2O��l�� ��H= ��285.8 kJ/mol
��H2��g��+![]() O2��g��= H2O��g�� ��H= ��241.8kJ/mol
O2��g��= H2O��g�� ��H= ��241.8kJ/mol
��C(s)+![]() O2 (g) = CO (g) ��H= ��110.5kJ/mol
O2 (g) = CO (g) ��H= ��110.5kJ/mol
��C(s)+ O2 (g) = CO2 (g) ��H= ��393.5kJ/mol
�ش��������⣺
������Ӧ�����ڷ��ȵ���_________��H2��ȼ����Ϊ________��C��ȼ����Ϊ_____��
��2�����͵���Ҫ�ɷ������飨C8H18����1 mol C8H18��l����O2��g����ȼ�գ�����CO2��g����H2O��l�����ų�5518 kJ��������д���˷�Ӧ���Ȼ�ѧ����ʽ___________
��3����������������Ӧ����1molˮ��������241.8kJ����1gˮ����ת����Һ̬ˮʱ����2.444kJ����д��������ȼ���ȵ��Ȼ�ѧ����ʽ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������ʣ��������ǵ���Һ��ͨ��һ����Ӧ��ʵ����ͼ��ʾ��ת������
ѡ�� | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�Ļ������ö���������ļ��ž�����Ҫ�����塣��2L�ܱ������У�����2.00molCO2��2.0 mol H2�Լ�����������Ӧ��CO2(g)+H2 (g)![]() HCOOH(g) ��H����ã�n(H2)/mol�ڲ�ͬ�¶���ʱ��ı仯���±���
HCOOH(g) ��H����ã�n(H2)/mol�ڲ�ͬ�¶���ʱ��ı仯���±���
60 min | 90 min | 120 min | 150 min | 180 min | ||
ʵ��I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
ʵ��� | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)�Ƚ�ʵ���¶�T1___T2(����������������)���÷�Ӧ����H___0(������������=����������)��
(2)ʵ��I��0��60 min����HCOOH��ʾ�ĸ÷�Ӧ��ƽ����Ӧ����Ϊ_____��
(3)ʵ���Ӧ��ʼʱ��ϵѹǿΪP0����90minʱ��ϵѹǿΪPl����Pl��P0=___��
(4)�Ƚ�ʵ��I������80minʱ���淴Ӧ���ʴ�Сvl___v��(�����������������������ж���)��ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ٴ������ʾ��������୶��¹ڷ�����һ������Ч���������� I �Ǻϳ�������୵��м��壬һ�ֺϳ�·�����£�
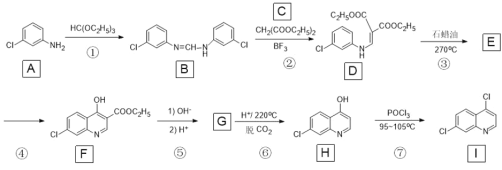
�ش��������⣺
(1)A �еĹ�����������______________��
(2)C �Ļ�ѧ����Ϊ________________��
(3)���ķ�Ӧ������___________________��
(4)��֪��Ϊȡ����Ӧ����һ������Ϊ�Ҵ���E �Ľṹ��ʽΪ_____________________��
(5)д�� F ������NaOH ��Һ��Ӧ�Ļ�ѧ����ʽ__________________��
(6)H ��һ�������¿���ת��Ϊ M( )����д������һ��ͬʱ������������ M ��ͬ���칹��__________________��������-NH2 �ķ����廯��� ���˴Ź��������� 4 ���
)����д������һ��ͬʱ������������ M ��ͬ���칹��__________________��������-NH2 �ķ����廯��� ���˴Ź��������� 4 ���
(7)�����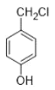 (���ǻ��л���)��CH3CH2OH Ϊ��Ҫԭ���Ʊ�
(���ǻ��л���)��CH3CH2OH Ϊ��Ҫԭ���Ʊ�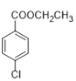 �ĺϳ�·��________��
�ĺϳ�·��________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com