
分析 (1)过氧化钠与二氧化碳、水反应均生成氧气,所以过氧化钠可用于呼吸面具和潜水艇中作为氧气的来源,原因是利用该反应可以将人体呼出的二氧化碳和水蒸气转化成人体需要的氧气,主要是呼出的二氧化碳和过氧化钠反应提供氧气;
(2)小苏打与盐酸反应生成氯化钠、水和二氧化碳;氢氧化铝与盐酸反应生成氯化铝和水,以此来解答;
(3)氧化铁与盐酸反应生成氯化铁和水,铁与氯化铁反应生成氯化亚铁,以此来解答.
解答 解:(1)人体呼出的二氧化碳和水蒸气,过氧化钠与二氧化碳反应生成碳酸钠和氧气,与水反应生成氢氧化钠和氧气,化学方程式:2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑,主要是呼出的二氧化碳和过氧化钠反应提供氧气,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(2)小苏打与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为NaHCO3+HCl=NaCl+CO2+H2O;氢氧化铝与盐酸反应生成氯化铝和水,离子反应为Al(OH)3+3H+=Al3++3H2O,
故答案为:NaHCO3+HCl=NaCl+CO2+H2O;Al(OH)3+3H+=Al3++3H2O;
(3)Fe2O3与盐酸反应生成氯化铁和水,离子方程式为Fe2O3+6H+=3H2O+2Fe3+;铁与三价铁离子发生氧化还原反应生成氯化亚铁,离子方程式为2Fe3++Fe=3Fe2+;故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 加热稀盐酸和MnO2的混合物 | |
| B. | 在KMnO4中加入NaCl和浓H2SO4并加热 | |
| C. | KCl加硫酸并加KClO2再加热 | |
| D. | 浓盐酸中加入浓H2SO4并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常,同周期元素的第一电离能ⅦA族的元素最大 | |
| B. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| C. | 第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 | |
| D. | 主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 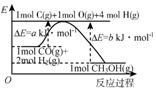 根据图可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH (g)△H=(b-a)kJ•mol-1 | |
| B. |  图表示2molH2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ | |
| C. | 1molNaOH分别和1molCH3COOH、1molHNO3反应,后者比前者△H小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的甲醇所含的氢原子数等于2NA | |
| B. | 常温常压下,Na2O2 与 H2O 反应生成 1mol O2 时,转移电子数是 2NA | |
| C. | 25℃时,Kap(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-6 NA | |
| D. | 1L 1 mol/L AlCl3溶液中含有的Al3+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
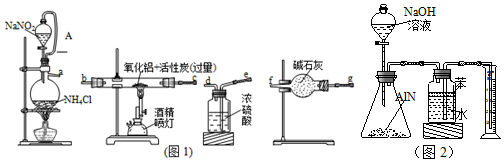
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 向碳酸钠溶液中逐滴加入等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com