
【题目】碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊试液变蓝色B.能与盐酸反应生成水
C.能与Na2S04溶液反应生成BaS04沉淀D.能与CO2反应生成水
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量NaHCO3杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
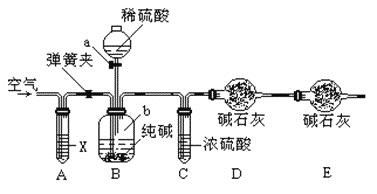
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为m1g;
③准确称得m2g纯碱样品放入容器b中;
④打开仪器a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3g 。
⑥根据所得数据计算。试回答:
(1)仪器a的名称是___________
(2)装置B中发生反应的离子方程式_____________________________________。
(3)步骤⑤鼓入空气的目的是__________________________________________________。
(4)装置A中试剂X应选用______
A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl
(5)如果将a的硫酸换成浓度相同的盐酸,则会导致测定结果______(“偏大”或“偏小”“不变”)
(6)如果除纯碱样品外,没有其他试剂,请设计一个也能测定纯碱样品中Na2CO3的质量分数的实验方案。主要步骤(不需要具体操作)_________________________有关化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
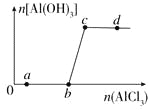
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SiO2溶于水显酸性
B.SiO2是一种空间立体网状结构的晶体,熔点高、硬度大
C.光导纤维导电能力很强,是一种很好的通信材料
D.SiO2是一种酸性氧化物,它可以与NaOH溶液反应,但不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种仿生高聚物(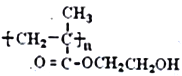 )的单体。由化合物A(C4H8)制备H的一种合成路线如下:
)的单体。由化合物A(C4H8)制备H的一种合成路线如下:
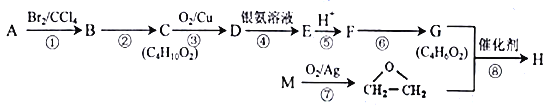
已知:A与M互为同系物。回答下列问题:
(1)A的系统命名为_____________。D分子中含有的官能团名称为__________________。
(2)F→G的反应条件为______________________。反应②、⑦的反应类型分别为_________、_________。
(3)反应⑧的化学方程式为___________________________________。
(4)化合物X为H的同分异构体,X能与新制的氢氧化铜悬浊液反应生成砖红色沉淀,还能与Na2CO3饱和溶液反应放出气体,其核磁共振氢谱有4种峰。写出两种符合要求的X的结构简式_____________________________________________________。
(5)根据上述合成中的信息,试推写出以乙烯、乙酸为原料经三步制备CH3-COOCH=CH2的合成路线_______________________________________(其他试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法中正确的是( )
A.自然界中硅元素的含量最丰富B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片D.光导纤维的主要成分是硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 用白醋除铁锈:Fe2O3+6H+==3H2O+2Fe3+
B. 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-![]() NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
C. 氯化亚铁溶液在空气中慢慢滴入过量氨水,产生白色沉淀:Fe2++2NH3H2O=Fe(OH)2↓+2NH4+
D. NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________。
(2)A、B、C三种元素的第一电离能由大到小的顺序为______________(用元素符号表示),原因是___________________。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________,组成微粒的中心原子的轨道杂化类型为____________,空间构型是___________。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________,一个E的晶胞质量为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。

③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com