

| ||


科目:高中化学 来源: 题型:
| A、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B、某溶液中滴加BaCl2溶液,生成不溶于水稀HNO3的白色沉淀,证明一定含有SO42- |
| C、验证烧碱溶液中是否含Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| D、某无色溶液滴入石蕊试液显红色,该溶液一定是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
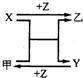 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
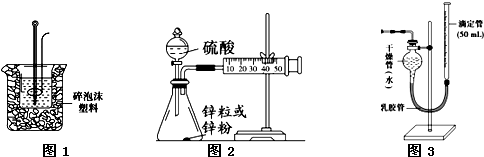
查看答案和解析>>
科目:高中化学 来源: 题型:
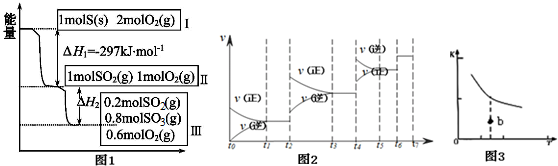
查看答案和解析>>
科目:高中化学 来源: 题型:
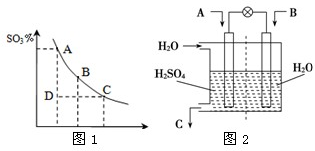 已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该白色粉末为NH4HCO3 |
| B、该白色粉末为(NH4)2CO3 |
| C、该白色粉末为NH4HCO3与(NH4)2CO3 混合物且物质的量之比为1:2 |
| D、该白色粉末为NH4HCO3与(NH4)2CO3 混合物且物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com