
(13分)试根据下表填空:
A
B C D E F
G H I J L K M
N Q
(1)请写出元素Q的基态原子电子排布式 ;元素N在周期表中的位置 周期 族。
(2)基态D原子核外有 个未成对电子;D2分子中分别有 个, 个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式 。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是 (填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是 (填化学式),它是由_ 键(填“极性”或“非极性”,下同)构成的 分子。
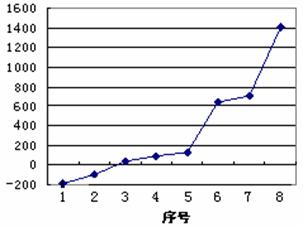
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是 (填元素符号);其中气态氢化物稳定性最强的元素是 (填下图中的序号)。

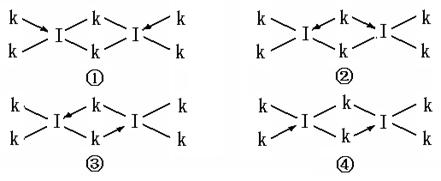
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。
(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式 ;最后生成配离子的结构式为 。
(1)(2分)1s22s22p63s23p63d104s1; 第4周期 VIII族。
(2) 3; 1 , 2。
(3)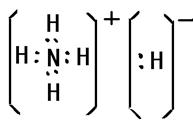
(4) SO2; SO3 ; 极性; 非极性
(5) Si 、 2 ;(6) ③ 。(7)Cu2++2NH3?H2O= Cu(OH)2↓+2NH4+
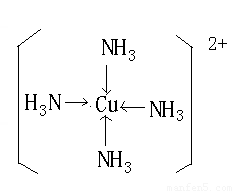
Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+ + 2OH-。
【解析】
试题分析:根据所给的部分周期表可以确定元素分别是:A: H B: Be C: C D: N E: O F: F G: Na H: Mg I: Al J: Si K: Cl L: S M: Ar N:Fe Q: Cu
出元素Q即铜的基态原子电子排布式1s22s22p63s23p63d104s1;元素N即铁在周期表中的位置四周期VIII族;基态D即氮原子核外有3个未成对电子;D2分子中分别有1个,2个π键;化合物DA5即NH5是离子化合物其中既含离子键,又含共价键和配位键,它的电子式是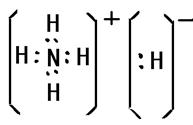
;表四中的元素能形成XY2型的共价分子有CE2即二氧化碳、CL2二硫化碳、BK2即氯化铍、LE2即二氧化硫四种,其分子的空间构型中有一种与其他三种不同,它是SO2;而形成XY3型的共价分子也有四种,它们分别是DA3即氨气、DF3即三氟化氮、DK3即三氯化氮、LE3即三氧化硫,其分子的空间构型中也有一种与其他三种不同,它是SO3,它是由极性键构成的非极性键分子;第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是Si , 其中气态氢化物稳定性最强即非金属性最强的元素是2;科学家证实,IK3即氯化铝属于共价化合物,分子式为Al2Cl6,会形成配位键,所以其结构式是 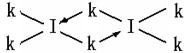
;向Q即铜的硫酸盐即硫酸铜溶液中加入足量的DA3的水溶液即氨水的过程中,请写出发生反应的离子方程式Cu2++2NH3?H2O= Cu(OH)2↓+2NH4+;Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+ + 2OH-。
最后生成配离子的结构式为 。
。
考点:元素周期表和元素周期律
点评:对于此类题目,要求学生对元素周期表一定要熟悉,能根据元素的位置关系准确找出元素。


科目:高中化学 来源: 题型:阅读理解
质检总局通报全国婴幼儿奶粉三聚氰胺含量抽检结果,伊利、蒙牛、圣元、雅士利等22个厂家69批次产品中检出三聚氰胺,并被要求立即下架。乳制品的蛋白氮的测定是质检部门的一个常见的工作。实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: 4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
![]() 步骤I 称取样品1.500 g。
步骤I 称取样品1.500 g。
![]() 步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
![]() 步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
![]() ⑴根据步骤III 填空:
⑴根据步骤III 填空:
![]() ①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
![]() ②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
![]() ③滴定时边滴边摇动锥形瓶,眼睛应观察____________
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
![]() A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
![]() ④滴定达到终点时,酚酞指示剂由_________色变成_________色。
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
![]() ⑵滴定结果如下表所示:
⑵滴定结果如下表所示:
| 滴定
| 待测溶液的体积
| 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市金乡一中高一2月月考化学试卷(带解析) 题型:填空题
(13分)试根据下表填空:
| A | | | ||||||||||||||||
| | B | | | C | D | E | F | | ||||||||||
| G | H | I | J | | L | K | M | |||||||||||
| | | | | | | | N | | | Q | | | | | | | | |


查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春外国语学校高二上学期期末考试化学试卷 题型:填空题
(12分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
若实验操作、数据记录均是正确的,试分析数据回答下列问题: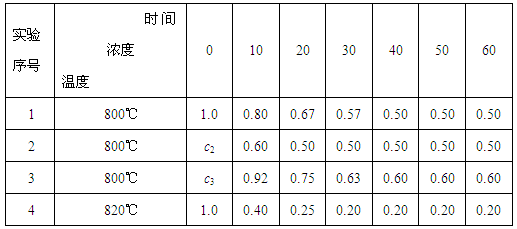
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
试根据下表填空:
| A | ||||||||||||||||||
| B | C | D | E | F | ||||||||||||||
| G | H | I | J | L | K | M | ||||||||||||
| N | Q |
| ||||||||||||||||
(1)请写出元素Q的基态原子电子排布式 ;元素N在周期表中的位置 周期 族。
(2)基态D原子核外有 个未成对电子;D2 分子中分别有 个, 个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式 。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是 (填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是 (填化学式),它是由_ 键(填“极性”或“非极性”,下同)构成的 分子。
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是 (填元素符号);其中气态氢化物稳定性最强的元素是 (填下图中的序号)。
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。

(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式 ;最后生成配离子的结构式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com