
【题目】脱去冶金工业排放烟气中SO2的方法有多种.
(1)利用本生(Bunsen)热化学循环吸收SO2工艺由下列三个反应组成: 2H2(g)+O2(g)═2H2O(I)△H1=﹣572kJmol﹣1
2HI(g)═H2(g)+I2(g)△H2=+10kJmol﹣1
2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJmol﹣1
则得SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=kJmol﹣1
(2)氧化锌吸收法.配制ZnO悬浊液,在吸收塔中封闭循环脱硫.测得pH、吸收效率η随时间t的变化如图1所示;溶液中部分微粒与PH的关系如图2所示. 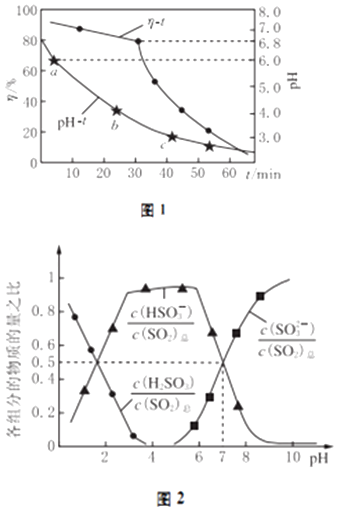
①为提高SO2的吸收效率η,可采取的措施有:增大悬浊液中ZnO的量、 .
②图1中的pH﹣t曲线ab段发生的主要化学方程式为
③pH=7时,溶液中 ![]() =
=
(3)如图3所示,利用惰性电解电解含SO2的烟气回收S及H2SO4 , 以实现废物利用. 
①阴极的电极反应式为 .
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量分别为、 .
【答案】
(1)+45
(2)调节溶液的pH至6.8以上;ZnSO3+SO2+H2O=Zn(HSO3)2;![]()
(3)SO2+4H++4e﹣=S↓+2H2O;0.1mol;0.2mol
【解析】解:(1)①2H2(g)+O2(g)═2H2O(I)△H1=﹣572kJmol﹣1②2HI(g)═H2(g)+I2(g)△H2=+10kJmol﹣1③2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJmol﹣1结合盖斯定律计算,(①+2×②+③)× ![]() 得到热化学方程式为:2HI (g)+H2SO4(I)=SO2(g)+I2(g)+2H2O(I)△H=﹣45KJ/mol,方向改变得所需热化学方程式:SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=+45KJ/mol,
得到热化学方程式为:2HI (g)+H2SO4(I)=SO2(g)+I2(g)+2H2O(I)△H=﹣45KJ/mol,方向改变得所需热化学方程式:SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=+45KJ/mol,
所以答案是:+45;(2)①增大悬浊液中ZnO的量,可以充分吸收二氧化硫,从而提高吸收效率,根据图1中吸收效率与溶液的Ph关系看,溶液的pH越低,吸收效率越低,为提高SO2的吸收效率η,增大悬浊液中ZnO的量,溶液的pH在6.8以上时吸收效率最增大,
所以答案是:调节溶液的pH至6.8以上;②段溶液的pH介于4~6之间,结合图2可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH﹣t曲线ab段发生的主要反应为:ZnSO3+SO2+H2O=Zn (HSO3)2 ,
所以答案是:ZnSO3+SO2+H2O=Zn(HSO3)2;③根据图2可知,当溶液的pH=7时,溶液的亚硫酸氢根离子和亚硫酸根离子相同,物质的量之比图形中可知为1:1,ZnSO3 , Zn(HSO3)2按照1:0.5混合,锌离子和亚硫酸根离子物质的量之比= ![]() ,
,
所以答案是: ![]() ;(3)①阴极上是二氧化硫得到电子生成硫单质,电极反应为:SO2+4H++4e﹣=S↓+2H2O,
;(3)①阴极上是二氧化硫得到电子生成硫单质,电极反应为:SO2+4H++4e﹣=S↓+2H2O,
所以答案是:SO2+4H++4e﹣=S↓+2H2O; ②每处理含19.2g SO2的烟气物质的量= ![]() =0.3mol,阴极上是二氧化硫得到电子生成硫单质,电极反应为:SO2+4H++4e﹣=S↓+2H2O,阳极电极反应为:SO2﹣2e﹣+2H2O=SO42﹣+4H+ , 电子守恒得到S~2H2SO4~4e﹣ ,
=0.3mol,阴极上是二氧化硫得到电子生成硫单质,电极反应为:SO2+4H++4e﹣=S↓+2H2O,阳极电极反应为:SO2﹣2e﹣+2H2O=SO42﹣+4H+ , 电子守恒得到S~2H2SO4~4e﹣ ,
理论上回收S、H2SO4的物质的量分别为0.1mol,0.2mol,
所以答案是:0.1mol、0.2mol.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用量筒量取 5mL 蒸馏水
B.用分液漏斗分离乙醇和水
C.用托盘天平称量 NaCl 固体 5.8g
D.用 pH 试纸测氯水的 pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B.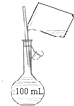 配制100 mL 0.10 molL﹣1NaCl溶液
配制100 mL 0.10 molL﹣1NaCl溶液
C. 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D. 称量25 g NaOH
称量25 g NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是(填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G对多种植物病原菌具有抑制作用,由丙酮合成G的路线如下: 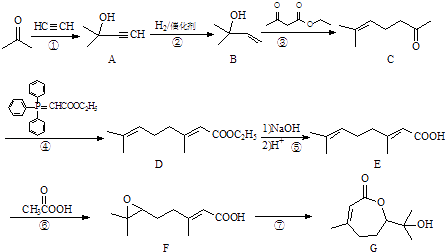
(1)写出化合物G中含氧官能团的名称 .
(2)反应②的类型为 .
(3)反应①还会得到另一产物H,其分子式为C8H14O2 , 写出H的结构简式 .
(4)反应⑦生成的G会部分转化为另一产物I,Ⅰ为链状结构,分子式为C10H18O4 , 写出Ⅰ的结构简式:
(5)一分子G消去一分子水可得物质J,写出同时满足下列条件的J的一种同分异构体的结构简式: ①能与FeCl3溶液发生显色反应;②分子的核磁共振氢谱有2个峰.
(6)以CH3OH、CH≡CH为原料合成聚丙烯醇 ![]() ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中的乙烯以得到纯净乙烷的方法是( )
A. 通过足量的NaOH(aq)
B. 通过足量的溴水
C. 在Ni催化、加热条件下通入H2
D. 通过足量的酸性KMnO4(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO﹣+H+ , 要使溶液中 ![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液
B.降低温度
C.加少量冰醋酸
D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种治疗关节炎止痛药,合成F的一种传统法路线如图: 
(1)B中含氧官能团的名称为 .
(2)C→D的反应可分为两步,其反应类型为、 .
(3)写出比F少5个碳原子的同系物X的结构简式:(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有种. ①属于芳香族化合物 ②苯环上只有1个取代基 ③属于酯类物质
(4)写出E转化为F和无机盐的化学方程式: .
(5)已知: ① ![]() ②
② ![]() (R、R′表示烃基)
(R、R′表示烃基)
合成F的一种改良法是以2﹣甲基﹣1﹣丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g),K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应的△H>0
B.随着反应的进行,混合气体的密度逐渐减小
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com