
| n |
| c |
| 47.8g×15% |
| 239g/mol |
| 0.03mol |
| 0.5mol/L |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=2H2O(g)+CO2(g)△H=-802.3kJ?mol-1 | ||
C、CO(g)+
| ||
| D、2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子、分子都是构成物质的微粒 |
| B、原子、分子总在不断运动 |
| C、分子可以再分,原子不能再分 |
| D、分子间有一定的间隔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
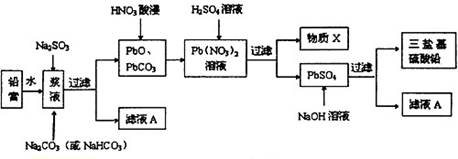
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
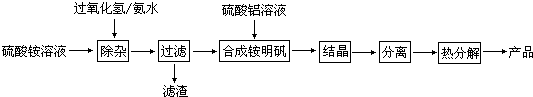
查看答案和解析>>
科目:高中化学 来源: 题型:
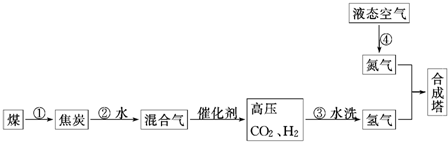
查看答案和解析>>
科目:高中化学 来源: 题型:
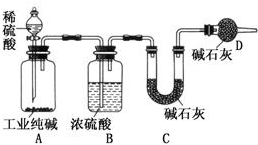 工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com