
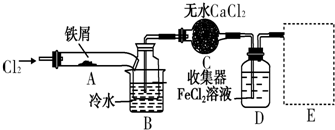
分析 装置A中铁与氯气反应,反应为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;为防止外界空气中的水蒸气进入装置使FeCl3潮解,所以用装置C无水氯化钙来吸水,装置D中用FeCl2吸收Cl2时的反应离子方程式2Fe2++Cl2═2Fe3++2Cl-,用装置D中的副产品FeCl3溶液吸收H2S,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,所以装置E为氢氧化钠溶液吸收氯气,据此分析解答.
解答 解:(1)装置A中铁与氯气反应生成氯化铁,化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,第④步操作是对FeCl3加热发生升华使沉积的FeCl3进入收集器;
故答案为:在沉积的FeCl3固体下方加热;
(3)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2⑤用干燥的N2赶尽Cl2;
故选:②⑤;
(4)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品,装置C的名称为干燥管;检验FeCl2是否失效的试剂为K3[Fe(CN)6]溶液,生成蓝色沉淀未失效,反之失效;
故答案为:冷却,使FeCl3沉积,便于收集产品;干燥管;K3[Fe(CN)6]溶液;
(5)氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,装置为: ;
;
故答案为: ;
;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+;
故答案为:2Fe3++H2S═2Fe2++S↓+2H+;
(7)电解池为电解亚铁离子的溶液,H+在阴极放电产生H2,阳极为亚铁离子失去电子发生氧化反应,电极反应式为Fe2+-e-═Fe3+;
故答案为:Fe2+-e-═Fe3+;
(8)综合分析实验Ⅱ的两个反应,电解池中最终得到的FeCl3可重新用来吸收H2S,得到循环利用,
H2S的原子利用率为100%、FeCl3得到循环利用;
故答案为:FeCl3得到循环利用.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 凡能导电的物质一定是单质 | |
| B. | 金属单质都能与稀硫酸发生置换反应 | |
| C. | 在化学反应中,金属单质失电子,常作还原剂 | |
| D. | 活泼金属都能从盐溶液中置换出较不活泼的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下反应2M2++Z2═2M3++2Z-可以发生 | |
| B. | Z元素在反应①中被还原,在③中被氧化 | |
| C. | 氧化性强弱顺序为:XO4->Z2>R2>M3+ | |
| D. | 还原性强弱顺序为:X2+<Z-<R-<M2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L空气中O2、N2分子总数目为NA | |
| B. | 0.1 mol羟基中所含电子数目为NA | |
| C. | 28 g乙烯、丙烯混合气体中所含原子数为6NA | |
| D. | 5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| B. | 铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个 | |
| C. | 常温下,4.4克二氧化碳和二氧化氮中的混合物中氧原子数为0.2NA | |
| D. | 标准状况下,11.2升氯气溶于水,转移电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止试管破裂,加热固体高锰酸钾制氧气时,试管口应略向下倾斜 | |
| B. | 进行SO2性质探究实验时,多余的SO2应排到实验室外 | |
| C. | 为防止药品污染,实验结束后,用剩的白磷可溶解于CS2后倒入垃圾箱 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,然后边搅拦边慢慢加入浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| B. | 硫酸铜与烧碱反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 苯酚与碳酸钠反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| D. | 碳酸钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原产物为CH3COOH | |
| B. | 氧化剂与还原剂的物质的量之比为2:3 | |
| C. | Cr2O72-和Cr3+分别属于反应物和生成物 | |
| D. | 若把该反应设计从成原电池,则负极反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com