

分析 (1)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(2)废液中通入热空气进行预处理,使醋酸铜氨分解得到尾气中有CO、氨气和剩余空气,向溶液中加入硫酸得到硫酸铜、硫酸铵,向硫酸铜、硫酸铵中加入硫化钠溶液得到CuS和母液,将CuS加入硝酸中得到S、NO和硝酸铜,将硝酸铜溶液蒸发浓缩、冷却结晶、过滤得到硝酸铜晶体,结合题目分析解答.
解答 解:(1)a.无论反应是否达到平衡状态都存在v(CO)正=v(NH3)正,不能据此判断平衡状态,故错误;
b.反应前后气体压强减小,当容器内气体压强不再随时间变化时,正逆反应速率相等,反应达到平衡状态,故正确;
c.[Cu(NH3)2]+浓度不再随时间变化时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bc;
(2)废液中通入热空气进行预处理,使醋酸铜氨分解得到尾气中有CO、氨气和剩余空气,向溶液中加入硫酸得到硫酸铜、硫酸铵,向硫酸铜、硫酸铵中加入硫化钠溶液得到CuS和母液,将CuS加入硝酸中得到S、NO和硝酸铜,将硝酸铜溶液蒸发浓缩、冷却结晶、过滤得到硝酸铜晶体
①通过以上分析知,还有NH3,故答案为:NH3;
②硫酸铜和硫化钠发生复分解反应生成黑色沉淀CuS,离子方程式为Cu2++S2-=CuS↓,故答案为:Cu2++S2-=CuS↓;
③硝酸溶解CuS生成S、NO、硝酸铜和水,反应方程式为3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O,
故答案为:3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O;
④363gCu(NO3)2•3H2O中Cu的质量=363g×$\frac{64}{242}$÷(1-2%)÷(1-4%)=102g,
故答案为:102.
点评 本题考查物质分离提纯及化学平衡状态判断,为高频考点,侧重考查学生获取信息、利用信息、元素化合物知识综合运用能力及分析判断能力,明确流程图中发生的反应及物质性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 电子垃圾的回收利用,可减少对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |
| A | SO2 | NaClO溶液 | CO2 |
| B | 盐酸 | 浓硫酸 | Cu |
| C | NH3 | O2 | Mg |
| D | Na2O2 | H2O | SiO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
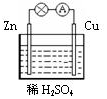
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
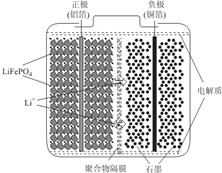 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 | |
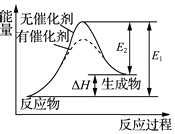
| C. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 | |
| D. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com