
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
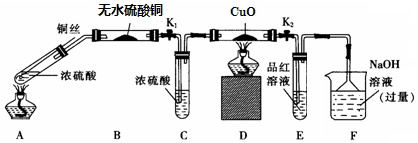
分析 加热条件下,Cu和浓硫酸发生氧化还原反应生成硫酸铜、二氧化硫和水,水具有挥发性,温度越高挥发性越强,所以生成的二氧化硫中含有水蒸气,水蒸气能使无水硫酸铜变蓝色;浓硫酸具有吸水性,能干燥二氧化硫气体;氢气具有还原性,能将黑色的氧化铜粉末还原为红色Cu;二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱性溶液吸收.
(1)二氧化硫和NaOH反应生成亚硫酸钠和水;
(2)实验过程中,要证明浓硫酸中硫元素的氧化性强于氢元素,只要证明生成的气体中含有二氧化硫不含氢气即可;
(3)实验结束时,撤去所有酒精灯之前要防止倒吸;
(4)验证生成的溶液中含有铜离子,需要把试管中的液体倒入水中溶解,观察是否出现蓝色溶液,将A装置中冷却的混合溶液沿烧杯内壁缓缓倒入盛水的烧杯中,并不断搅拌,出现蓝色溶液证明含有铜离子;
(5)根据转移电子及原子守恒配平方程式,从而确定a、b关系;
(6)图表数据分析铜和浓硫酸反应过程中会生成黑色物质证明有副反应,浓度合适会避免黑色固体出现,浓度越大,温度越高黑色越难消失.
解答 解:加热条件下,Cu和浓硫酸发生氧化还原反应生成硫酸铜、二氧化硫和水,水具有挥发性,温度越高挥发性越强,所以生成的二氧化硫中含有水蒸气,水蒸气能使无水硫酸铜变蓝色;浓硫酸具有吸水性,能干燥二氧化硫气体;氢气具有还原性,能将黑色的氧化铜粉末还原为红色Cu;二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱性溶液吸收.
(1)二氧化硫属于酸性氧化物,和NaOH反应生成亚硫酸钠和水,离子反应方程式为 SO2+2OH-=SO32-+H2O;故答案为:SO2+2OH-=SO32-+H2O;
(2)证明浓硫酸中硫元素的氧化性强于氢元素,利用元素化合价变化生成的产物分析判断,若生成氢气,D装置会黑色变化为红色,若生成二氧化硫E装置中品红会褪色,所以证明浓硫酸中硫元素的氧化性强于氢元素的实验现象是,D装置中氧化铜黑色不变化,说明无氢气生成,E装置中品红试液褪色说明生成了二氧化硫气体,
故答案为:D装置中黑色固体颜色无变化,E装置中溶液褪色;
(3)实验结束时,拉起铜丝,撤去所有酒精灯之前必须完成的实验操作是关闭K1,K2,防止CE中的溶液倒吸,炸裂玻璃管,
故答案为:拉起铜丝,关闭K1,K2;
(4)验证生成的溶液中含有铜离子,需要把试管中的液体倒入水中溶解,观察是否出现蓝色溶液,将A装置中冷却的混合溶液沿烧杯内壁缓缓倒入盛水的烧杯中,并不断搅拌,出现蓝色溶液证明含有铜离子,
故答案为:将A装置中试管内冷却后的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,若溶液变蓝,证明含有Cu2+;
(5)aCu+bH2SO4$\frac{\underline{\;\;△\;\;}}{\;}$cCu2S+dCuSO4+e H2O中Cu元素化合价由0价变为+1价、+2价、S元素化合价由+6价变为-2价,转移电子数为6,根据转移电子守恒及原子守恒配平方程式为5Cu+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+3CuSO4+4H2O,所以a:b=5:4,
故答案为:5:4;
(6)依据图表数据分析可知,浓度不同时出现黑色物质的时间随浓度增大减小,浓度为18mol/L时生成的黑色物质不能消失;
A.分析过程可知.发生的反应过程中生成二氧化硫和硫酸铜的反应过程中有奇谈反应发生生成黑色物质,铜与浓硫酸反应时所涉及的反应可能不止一个,故A符合;
B.图表数据分析可知硫酸浓度选择适当,可避免最后产物中出现黑色物质,故B符合;
C.浓硫酸和铜的反应浓度小于15mol/L也可能出现黑色物质,出现的时间长,该反应发生的条件不一定是硫酸浓度≥15mol•L-1,故C不符合;
D.图表数据中,18mol/L的浓硫酸,出现褐色物质的时间短,黑色物质难以消失,所以硫酸浓度越大,黑色物质越快出现、越难消失,故D符合;
故答案为:ABD.
点评 本题以浓硫酸和铜的反应为载体考查性质实验方案设计,涉及气体制取、气体检验、反应方程式的配平、方程式的计算等知识点,综合性较强,明确反应原理及基本操作是解本题关键,知道二氧化硫、氢气的检验方法及顺序,题目难度中等.


科目:高中化学 来源: 题型:解答题
 如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:
如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 3mol•L-1Na2S2O3的溶液 | B. | 20mL 2mol•L-1Na2S2O3的溶液 | ||
| C. | 10mL 4mol•L-1Na2S2O3的溶液 | D. | 10mL 2mol•L-1Na2S2O3的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,20mlNH3与60mlO2所含分子个数比为1:3 | |
| B. | 在化学反应中,1mol金属镁变为镁离子时失去电子数为NA | |
| C. | 在标准状况下,1mol水的体积为22.4L | |
| D. | 2molCaCl2中Cl-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5s时,正、逆反应速率都达到最大 | |
| B. | 前5s内平均反应速率υ(Y)=0.1 mol/( L•s) | |
| C. | 达平衡时,各物质的浓度都保持不变,反应停止 | |
| D. | 升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中,氧化剂与还原剂的物质的量之比为2:5 | |
| B. | 反应②中,Cu3P既是氧化产物又是还原产物 | |
| C. | 反应②中,当有5mol CuSO4发生反应时,共转移电子10mol | |
| D. | 反应①中CuSO4做氧化剂,反应②中CuSO4作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com