
 �����⻯��Ļ�ѧʽΪAsH3��
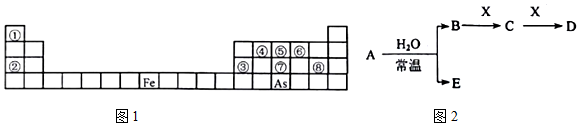
�����⻯��Ļ�ѧʽΪAsH3������ I����Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪNa����ΪAl����ΪC����ΪN����ΪO����ΪP����ΪCl��Ȼ����Ԫ�ػ�����֪ʶ����ѧ������1������4����
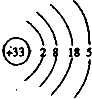
II��AΪ����ɫ���壬A��ˮ��Ӧ����ǿ��B����AΪNO2��BΪHNO3��XΪ�����������ʣ�X�����ᷴӦ���ɵIJ��������X��Ӧ����XΪ��۽���������XΪFe��������Fe��Ӧ����Fe��NO3��3��Fe��NO3��3��Fe��Ӧ����Fe��NO3��2��A��ˮ��Ӧ���������E����EΪNO������AΪNO2��BΪHNO3��EΪNO��XΪFe��CΪFe��NO3��3��DΪFe��NO3��2���ݴ˷�����
��� �⣺��1�����Ӳ������Ӱ뾶������ͬ���Ӳ�ṹ�����ӣ�ԭ������С�İ뾶����ڡ��ޡ�������Ӱ뾶ΪCl-��O2-��Na+��
�ʴ�Ϊ��Cl-��O2-��Na+��
��2���ǽ�����Cl��P��C����ܡ��ߡ������ۺ����������ΪHClO4��H3PO4��H2CO3��
�ʴ�Ϊ��HClO4��H3PO4��H2CO3��
��3��As��ԭ�ӽṹʾ��ͼΪ ����ͼ�λ-3�ۣ����⻯��ΪAsH3��
����ͼ�λ-3�ۣ����⻯��ΪAsH3��
�ʴ�Ϊ�� ��AsH3��
��AsH3��
��4��Y�ɢڢޢ�����Ԫ����ɣ�����ˮ��Һ�������г�������������YΪNaClO����As�ķ�ӦΪ5NaClO+2As+3H2O�T2H3AsO4+5NaCl��AsԪ�صĻ��ϼ����ߣ�Ϊ��ԭ����������1mol��ԭ��ʱת�Ƶ���Ϊ1mol����5-0��=5mol��
�ʴ�Ϊ��5NaClO+2As+3H2O�T2H3AsO4+5NaCl��5��
��AΪ����ɫ���壬BΪǿ�ᣬXΪ�����������ʣ����ת����ϵ��֪��AΪNO2��HΪHNO3��EΪNO��XΪFe��CΪFe��NO3��3��DΪFe��NO3��2��
��1��A��ˮ��Ӧ�Ļ�ѧ����ʽΪ3NO2+H2O=2HNO3+NO��
�ʴ�Ϊ��3NO2+H2O=2HNO3+NO��
��2�����Ȼ�ԭ��ұ��X�Ļ�ѧ����ʽΪFe2O3+3CO$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2��
�ʴ�Ϊ��Fe2O3+3CO$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2��
��3��m��X��H2O��Ӧ�ų�QKJ ��Q��O������������1molFe��Ӧ�ų�$\frac{56Q}{m}$kJ�����������Ȼ�ѧ����ʽΪ3Fe��s��+4H2O��g���TFe3O4��s��+4H2��g����H=-$\frac{168Q}{m}$kJ/mol��
�ʴ�Ϊ��3Fe��s��+4H2O��g���TFe3O4��s��+4H2��g����H=-$\frac{168Q}{m}$kJ/mol��
���� ���⿼��λ�á��ṹ�����ʵĹ�ϵ����ϤԪ�����ڱ���Ԫ�������ɼ�Ԫ�������ڱ��е�λ�ü�Ԫ�ء����ʡ�����������ʼ��ɽ����Ŀ�Ѷ��еȣ������ڿ���ѧ���ķ��������ͶԻ���֪ʶ��Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¸���������������Ӧ�������ø�ƿ������ˮ | |
| B�� | Ũ���ᡢŨ���ᶼ����ǿ�����ԣ�����ʢ���ڽ��������� | |
| C�� | ʯӢ������ǿ��ǿ������¿����������������� | |
| D�� | Na2SiO3���Ʊ��轺��ľ�ķ������ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ϩ��1-��ϩ | B�� | ������Ȳ | ||
| C�� | 1-�ȱ����2-�ȱ��� | D�� | �����������ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ȡ | B�� | ���ǹ��� | ||
| C�� | ���Ƿ�Һ | D�� | ά����C������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
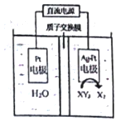 ���ֶ�����Ԫ�������ڱ��е����λ�����±���ʾ������Zԭ������������������Ӳ�����2 ����Ԫ��M��Zͬ���ڣ���ԭ�Ӱ뾶��ͬ���������ģ�Ԫ��R�ǵ������ڵĹ���Ԫ�أ�R�мס������ֳ�������������м��ڳ��������ڿ����У����ɰ�ɫ��Ϊ����ɫ������Ϊ���ɫ���ң�
���ֶ�����Ԫ�������ڱ��е����λ�����±���ʾ������Zԭ������������������Ӳ�����2 ����Ԫ��M��Zͬ���ڣ���ԭ�Ӱ뾶��ͬ���������ģ�Ԫ��R�ǵ������ڵĹ���Ԫ�أ�R�мס������ֳ�������������м��ڳ��������ڿ����У����ɰ�ɫ��Ϊ����ɫ������Ϊ���ɫ���ң�| X | Y | |
| Z | W |
 ��W����������ˮ����Ļ�ѧʽ��HClO4��
��W����������ˮ����Ļ�ѧʽ��HClO4���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0 | 1 | 3 | 5 |
| N��H2��/mol | 8 | 6 | 5 | 5 |
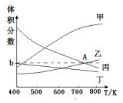
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
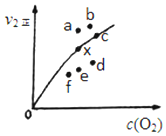 ���û�ѧ��Ӧԭ���о�������Ļ���������Ҫ���壮
���û�ѧ��Ӧԭ���о�������Ļ���������Ҫ���壮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com