
分析 ①泡沫灭火器原理:铝离子与碳酸氢根离子发生双水解生成氢氧化铝沉淀和二氧化碳气体;
②向Mg(OH)2悬浊液中滴加FeCl3溶液,氢氧化铁溶解度小于氢氧化镁,实现沉淀的转化生成氢氧化铁和氯化镁.
解答 解:①泡沫灭火器原理,离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②向Mg(OH)2悬浊液中滴加FeCl3溶液,氢氧化铁溶解度小于氢氧化镁,实现沉淀的转化生成氢氧化铁和氯化镁,离子方程式:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+;
故答案为:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+.
点评 本题考查了离子方程式的书写,明确盐类水解规律及沉淀转化规则是解题关键,注意化学式的拆分,题目难度不大.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰可用于人工降雨 | |
| B. | 雷雨时空气中的 N2可变为氮的化合物 | |
| C. | 使用合适的催化剂可将水变成汽油 | |
| D. | 一定条件下石墨能变成金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式 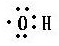 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 原子结构示意图 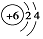 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
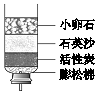
| A. | 净水过程中发生了化学变化 | B. | 该净水器能杀菌消毒 | ||
| C. | 活性炭的主要作用是吸附杂质 | D. | 净化后的水属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取氨气 | B. | 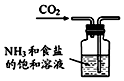 制取NaHCO3 | C. | 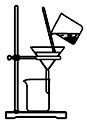 分离NaHCO3 | D. | 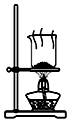 干燥NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
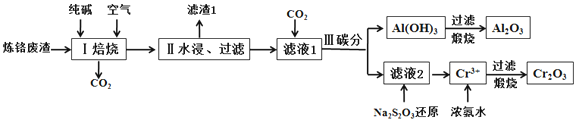
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com