
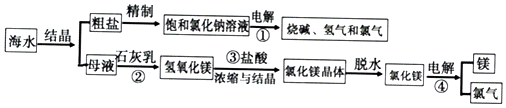
分析 海水结晶得到粗盐,除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,后面加入的试剂要能够除去前面所加入的过量试剂;母液加入石灰乳沉镁离子生成氢氧化镁沉淀过滤后的测定中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气,
(1)含元素化合价变化的反应为氧化还原反应,电解为氧化还原反应;
(2)除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,后面加入的试剂要能够除去前面所加入的过量试剂;
(3)反应①是电解饱和食盐水生成氯气、氢气和氢氧化钠;
(4)反应③是氢氧化镁溶解在盐酸中生成氯化镁和水;
(5)母液中通入氯气,还可以制备溴单质,是氯气氧化性大于溴单质,可以氧化溴离子生成溴单质;
解答 解:海水结晶得到粗盐,除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,后面加入的试剂要能够除去前面所加入的过量试剂;母液加入石灰乳沉镁离子生成氢氧化镁沉淀过滤后的测定中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气,
(1)含元素化合价变化的反应为氧化还原反应,电解为氧化还原反应,反应①、②、③、④中,属于氧化还原反应的是①④,电解饱和氯化钠溶液化学反应生成氢氧化钠、氯气和氯气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解熔融氯化镁反应化学方程式:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
故答案为:①④;
(2)除去钙离子选用碳酸钠、除去镁离子使用氢氧化钠、除去磷酸根离子选用氯化钡,由于含有多种杂质,所以加入的除杂试剂要考虑加入试剂的顺序,加入过量氯化钡溶液的顺序应该在加入碳酸钠溶液之前,以保证将过量的氯化钡除去,过滤后,最后加入盐酸,除去过量的碳酸钠,而氢氧化钠溶液只要在过滤之前加入就可以,所以一定不能在最后加入的试剂是BaCl2(或氯化钡),该四项合理的操作顺序为dcab,
故答案为:dcab;
(3)反应①的反应为电解饱和氯化钠溶液,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2NaOH;
(4)反应③是氢氧化镁溶解在盐酸中生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(5)母液中通入氯气,还可以制备溴单质,该反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
点评 本题考查较综合,涉及粗盐提纯、氧化还原反应判断,离子方程式书写等,为高考常见题型,利用所学知识结合流程图信息是解答本题的关键,题目难度中等.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 稀盐酸与小苏打溶液混合:CO32-+2H+=CO2↑+H2O | |
| C. | 鸡蛋壳溶于食醋:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,明矾,烧碱 | B. | 同素异形体:C60,石墨,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:纯净矿泉水,盐酸,漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个隔离的不同半电池通过盐桥连接可以组成原电池 | |
| B. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| C. | 在铁上镀银,用银作阳极 | |
| D. | 牺牲阳极的阴极保护法利用的是原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下纯水PH=6,则在该条件下PH=4的醋酸和PH=10的NaOH中水的电离程度相同 | |
| B. | NH4Cl溶于D2O的离子方程式:NH4+D2O?NH3•D2O+H+ | |
| C. | 已知S燃烧热为QKJ/mol,则S(s)+$\frac{3}{2}$O2(g)═SO3(g);△H=-QKJ/mol | |
| D. | 水的自偶电离方程式:2H2O?H3O-+OH-,则液氨自偶电离:2NH3?NH4++NH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列说法错误的是( )
A.过氧化钠可作航天员和潜水员的供氧剂
B.NaNO2可防止食物腐败,腌腊制品中的NaNO2对人体没有副作用
C.干冰和碘化银均可用于人工降雨
D.高铁车厢大部分材料采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com