
(16分)可逆反应2 Cl2 (g)+2H2O(g) 4HCl(g)+O2(g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
(1)降低温度,Cl2的转化率__ _____,平衡常数K
(2)保持容器体积不变,加入He,则HCl的物质的量______________
(3) 保持容器体积不变,加入Cl2,则Cl2的转化率_________,平衡常数K
(4)若恒温恒容,反应从Cl2和H2O开始至平衡,在这个变化过程中,平均相对分子质量____。
(5)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______;
(1)减小 减小 (2) 不变 (3) 减小 不变 (4) 减小
(5)没影响;催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响
解析:考查外界条件对化学平衡的影响。
根据反应式可知,该反应是体积增大的、吸热的可逆反应,所以降低温度平衡向正反应方向移动,转化率减小,平衡常数只与温度有关,所以平衡常数减小。保持容器体积不变,加入He,物质的浓度不变,平衡不移动,氯化氢的物质的量不变。增大氯气的浓度,氯气的转化率减小,平衡常数不变。如果从Cl2和H2O开始至平衡,体积增大。平均相对分子质量是混合气的质量和物质的量的比值,所以平均相对分子质量减小。催化剂能改变反应的活化能,但反应物和生成物的总能量是不变,反应热是不变的。


科目:高中化学 来源:2011-2012学年云南省武定县第一中学高二5月月考化学试卷(带解析) 题型:填空题
(16分)可逆反应2 Cl2 (g)+2H2O(g)  4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
(1)降低温度,Cl2的转化率__ _____,平衡常数K
(2)保持容器体积不变,加入He,则HCl的物质的量______________
(3) 保持容器体积不变,加入Cl2,则Cl2的转化率_________,平衡常数K
(4)若恒温恒容,反应从Cl2和H2O开始至平衡,在这个变化过程中,平均相对分子质量____。
(5)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______;
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省玉溪一中高二上学期期末考试化学试卷(带解析) 题型:实验题
(每空2分,共16分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO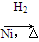 CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH:
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。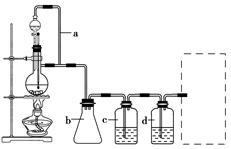
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: ____________________________________________________________________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓ ;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线: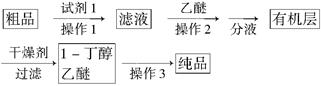
试剂1为________,操作1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源:2014届云南省高二上学期期末考试化学试卷(解析版) 题型:实验题
(每空2分,共16分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO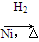 CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH:
CO的制备原理:HCOOH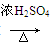 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: ____________________________________________________________________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓ ;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
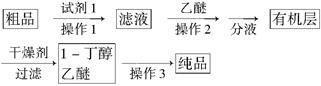
试剂1为________,操作1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源:2013届云南省高二5月月考化学试卷(解析版) 题型:填空题
(16分)可逆反应2 Cl2 (g)+2H2O(g)  4HCl(g)+O2
(g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2
(g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
(1)降低温度,Cl2的转化率__ _____,平衡常数K
(2)保持容器体积不变,加入He,则HCl的物质的量______________
(3) 保持容器体积不变,加入Cl2,则Cl2的转化率_________,平衡常数K
(4)若恒温恒容,反应从Cl2和H2O开始至平衡,在这个变化过程中,平均相对分子质量____。
(5)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com