
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
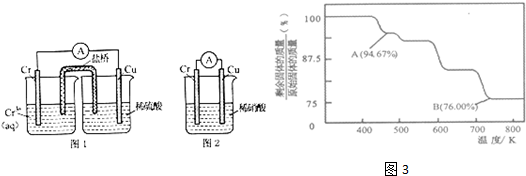
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2和NH3的物质的量分数不再改变 |
| B、c(N2):c(H2):c(NH3)=1:3:2 |
| C、单位时间每增加1molN2,同时增加2mol NH3 |
| D、N2与H2的物质的量之和是NH3的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为正极,Ag2O为负极 |
| B、Ag2O发生还原反应 |
| C、原电池工作时,正极区溶液pH值减小 |
| D、原电池工作时,负极区溶液pH值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
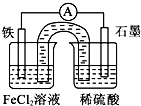
| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、Fe为负极,发生的反应为:Fe-3e-=Fe3+ |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、原电池装置中的盐桥完全可用金属导线代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸钠溶液中滴加与其溶质的物质的量相等的盐酸:CO32-+2H+═CO2↑+H2O |
| B、用Na2S处理含Hg 2+的废水:Hg2++S2-═HgS↓ |
| C、用Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-═CaCO3 |
D、邻羟基苯甲酸与足量的NaOH溶液混合: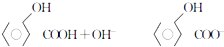 +H2O +H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com