
【题目】右图是可逆反应A+2B ![]() 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是
2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是

A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】“暖冰”是科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色。则下列说法不正确的是( )
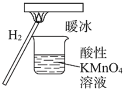
A.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧的产物中可能含有一定量的H2O2
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶物氢化亚铜(CuH)可用CuSO4溶液和“另一种反应物”在40℃~50℃时反应生成.CuH不稳定,易分解;CuH在氯气中能燃烧;常温下跟盐酸反应能产生气体,以下有关它的推断中不正确的是()
A.“另一种反应物”一定具有氧化性B.CuH既可做氧化剂也可做还原剂
C.2CuH + 3Cl2![]() 2CuCl2 + 2HCl↑D.CuH+HCl=CuCl↓+H2↑
2CuCl2 + 2HCl↑D.CuH+HCl=CuCl↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测21世纪中叶将进入“氢能经济”时代,下列物质都是具有广阔应用前景的储氢材料。回答下列问题:
(1)Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为_______。
(2)亚氨基锂(Li2NH) 所含元素第一电离能最小的是____ ,电负性最大的是_____ (填元素符号)。
(3)咔唑(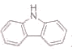 )的沸点比芴(
)的沸点比芴(![]() )高的主要原因是________。
)高的主要原因是________。
(4)①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为____。其中B的杂化类型为____,可通过_________测定该分子的立体构型。
②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4______H2O (填“> "或“<"),原因是________。
(5)MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。
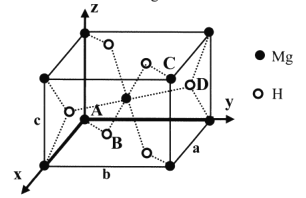
①Mg2+的半径为72pm,则H+的半径为______pm (列出计算表达式)
②用NA表示阿伏加德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的_____倍(列出计算表达式,氢气密度为0.089g·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹K,使两烧瓶内的气体充分混合后,容器内的压强最小的是
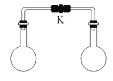
A.H2S和 SO2B.NH3和HCl
C.H2和Cl2D.NO和 O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g) + 3H2(g) ![]() 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1 ________K2(填写“>”、“=”或“<”)
(2) 400℃时,反应2NH3(g) ![]() N2(g) + 3H2(g)的化学平衡常数的值为_____________。
N2(g) + 3H2(g)的化学平衡常数的值为_____________。
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) ___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______(填“增大”、“减小”或“不变”),其原因是_________________________________________________________。
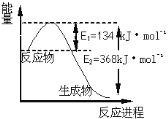
(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 等均是我国发明的深紫外非线性光学晶体。
等均是我国发明的深紫外非线性光学晶体。
(1)![]() 三种元素的电负性由大到小的顺序是__________________,
三种元素的电负性由大到小的顺序是__________________,![]() 的第一电离能从大到小的顺序是______________________。
的第一电离能从大到小的顺序是______________________。
(2)基态钾原子的核外电子排布式为____________________;![]() 的熔点比
的熔点比![]() 的低,其原因是___________________________________________。
的低,其原因是___________________________________________。
(3)![]() 溶于25%的
溶于25%的![]() 溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵
溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵![]() 晶体,再在
晶体,再在![]() 气流中加热至450℃可得
气流中加热至450℃可得![]() 。
。
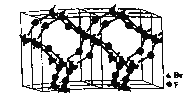
①气态![]() 是以单分子
是以单分子![]() 存在,固态
存在,固态![]() 的结构如图所示,气态
的结构如图所示,气态![]() 与固态
与固态![]() 的中心原子杂化方式依次为_____________、_________________。
的中心原子杂化方式依次为_____________、_________________。
②![]() 的空间构型为________________,画出
的空间构型为________________,画出![]() 的结构:_______________________.
的结构:_______________________.
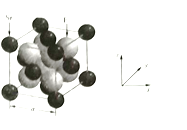
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,![]() 晶胞结构如图所示,品胞中与点
晶胞结构如图所示,品胞中与点![]() 距离最远的
距离最远的![]() 的原子分数坐标为_______________;
的原子分数坐标为_______________;![]() 的摩尔质量为
的摩尔质量为![]() ,晶胞的密度为
,晶胞的密度为![]() ,则晶胞参数
,则晶胞参数![]() ____________pm(用代数式表示)
____________pm(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.1mol Na被完全氧化生成Na2O2,失去个NA电子
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:

(1)D中的含氧官能团名称为________________(写两种)。
(2)F→G的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式____________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化

请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com