
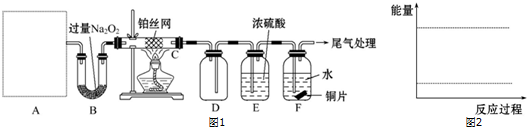
分析 实验是利用铵盐加热分解产生NH3,再将产生的NH3氧化,生成NO,然后继续氧化得到NO2,进而制得HNO3.装置A:是气体发生装置,试剂应选择分解后不易化合的NH4HCO3,装置B:可以将CO2、H2O全部吸收,同时生成O2,装置C:进入装置C的气体是物质的量相等的NH3和O2,在装置C中氧化得到NO,生成的NO、H2O以及未反应的NH3、O2都进入装置D,装置D:NO和O2反应生成NO2,装置E:吸收未反应的NH3及H2O,装置F:NO2溶于H2O生成HNO3,与铜反应.
(1)装置A:需制取氨气,试剂应选择分解后不易化合的药品,选择碳酸氢铵制取氨气,碳酸氢铵受热分解产生氨气、水和二氧化碳,装置F中NO2溶于H2O生成HNO3,与铜反应,据此分析F中的现象;
(2)二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气;
(3)反应放热,则反应物的总能量大于生成物的总能量;
(4)先判断溶液中的溶质,根据钠原子守恒计算过氧化钠的物质的量;盐酸与碳酸钠反应生成的二氧化碳与碳酸氢铵分解生成的二氧化碳相同,根据反应方程式判断二氧化碳和水及过氧化钠之间的关系式,从而计算二氧化碳的体积.
解答 解:实验是利用铵盐加热分解产生NH3,再将产生的NH3氧化,生成NO,然后继续氧化得到NO2,进而制得HNO3.装置A:是气体发生装置,试剂应选择分解后不易化合的NH4HCO3,装置B:可以将CO2、H2O全部吸收,同时生成O2,装置C:进入装置C的气体是物质的量相等的NH3和O2,在装置C中氧化得到NO,生成的NO、H2O以及未反应的NH3、O2都进入装置D,装置D:NO和O2反应生成NO2,装置E:吸收未反应的NH3及H2O,装置F:NO2溶于H2O生成HNO3,与铜反应.
(1)在该实验中,装置A中需制取氨气,在提供的药品中,因氯化铵受热分解生成氨气,在温度降低后,又化合生成氯化铵,所以选择碳酸氢铵,分解生成氨气,同时碳酸氢铵受热分解产生的水和二氧化碳能与过氧化钠反应生成氧气,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,装置F:NO2溶于H2O生成HNO3,与铜反应,3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,铜片溶解,溶液变为蓝色,
故答案为:a;铜片溶解,溶液变为蓝色;
(2)二氧化碳和过氧化钠反应生成碳酸钠和氧气2Na2O2+2CO2=2Na2CO3+O2,水和过氧化钠反应生成氢氧化钠和氧气2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑;
(3)反应放热,则反应物的总能量大于生成物的总能量,可表示为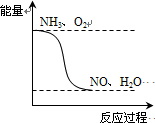 ,
,
故答案为: ;
;
(4)反应后溶液呈中性,则溶质为NaCl,根据n(HCl)=n(NaCl)=2n(Na2O2)可知,n(Na2O2)=$\frac{1}{2}$×n(HCl)=$\frac{1}{2}$×0.5L×1mol/L=0.25mol,
NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑
2H2O+2Na2O2=4NaOH+O2↑
2CO2+2Na2O2=2Na2CO3+O2
根据方程式知,碳酸氢铵分解生成的水和二氧化碳的物质的量相同,水和二氧化碳分别与过氧化钠反应需要的过氧化钠的物质的量相同,都是0.125mol;
碳酸氢铵生成的二氧化碳和过氧化钠反应生成碳酸钠,碳酸钠和盐酸反应生成的二氧化碳,所以碳酸钠与盐酸反应生成的二氧化碳和碳酸氢铵分解生成的二氧化碳相同.
设二氧化碳的体积为V.
2CO2+2Na2O2=2Na2CO3+O2
44.8L 2mol
V 0.125mol
V=2.8L
故答案为:0.25; 2.8.
点评 本题考查实验探究氮的化合物的性质方案设计,涉及物质的制备、化学反应方程式的计算等知识,题目难度中等,本题易错点为(4),注意有关反应的方程式的书写,根据方程式计算.


科目:高中化学 来源: 题型:选择题
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
| A. | 简单离子的半径大小顺序为:W>Q>Z>Y | |
| B. | W单质在氧气中燃烧后的产物不能使品红溶液褪色 | |
| C. | X、W和氢三种元素形成的化合物中只有共价键 | |
| D. | Z与W元素只能形成原子个数比为2:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 240 | 250 | 260 | 270 |
| 平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 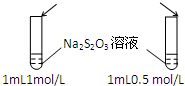 | 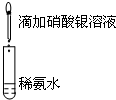 |
| C.目的:比较Al、Fe、Cu活动性 | D.目的:实验室制取氨气 |
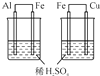 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 化学试剂 | 供选择的化学试剂 |
| 检验味精中是否含有食盐 | A.新制氢氧化铜悬浊液 B.硝酸银溶液和稀硝酸 C.碘水 D.碳酸钠粉末 | |
| 检验地瓜粉中是否含有淀粉 | ||
| 检验食醋中是否含有乙酸 | ||
| 区别蔗糖和葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
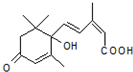 农艺师对盆栽鲜花施用了S-诱抗素剂(分子结构如图),以使鲜花按时盛开.
农艺师对盆栽鲜花施用了S-诱抗素剂(分子结构如图),以使鲜花按时盛开.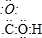
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 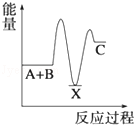 | B. | 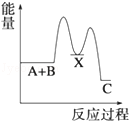 | C. |  | D. | 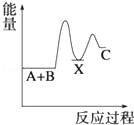 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨易液化,因此可用来作制冷剂 | B. | 氨水显弱碱性,能使酚酞溶液变红 | ||
| C. | 氨极易溶于水,因此氨水比较稳定 | D. | 氨极易溶于水,因此可作喷泉实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com