
(10分) 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g) ΔH=a kJ·mol-1,测得CO2和CO浓度随时间的变化如图所示:
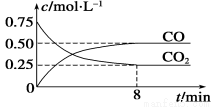
(1) 0~8 min,v(CO)=__________mol·L-1·min-1。
(2) 测得在不同温度下,K值如下:
温度(℃) | 500 | 700 |
平衡常数K | 2.00 | 2.50 |
①若500℃时进行反应,CO2起始浓度为3 mol·L-1,CO的平衡浓度为________。
②反应中的a________0(填“大于、小于、等于”)。
③下列措施中,能使平衡时c(CO)/c(CO2)的比值的增大的是________(填序号)。
A.升高温度 B.再加入一些铁粉 C.增大压强 D.充入一定量氮气
④在700℃时的某时刻测得CO2浓度为1.4mol·L-1,CO浓度为2.0mol·L-1,反应向 方向进行(填“正反应”或”逆反应”),理由是: 。
28.(共10分)
(1)0.0625(2分) (2)2mol/L(2分),> (1分),A(2分),
正反应(1分),由于Q<K则平衡向正反应方向进行(2分)。
【解析】
试题分析:(1)8min内,CO的平均反应速率v(CO)=0.5/8=0.0625mol?L-1?min-1;
(2) Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,
FeO(s)+CO(g) ΔH=a kJ·mol-1,
开始(mol/L): 3 0
变化(mol/L): X X
平衡(mol/L): 3-X X
x/(3-x)=2 计算可得X=2mol/L,①CO的平衡浓度为2mol/L,温度升高,K值增大,说明该反应为吸热反应,②反应中的a大于0;③该反应正反应为吸热反应,升高温度,平衡向正反应进行,c(CO)增大c(CO2)减小,所以 c(CO)/c(CO2)的值增大,A正确;铁粉为固体,浓度为定值,增加铁粉的用量,不影响平衡,c(CO)/c(CO2)的值不变,B错误;该反应反应前后气体的体积不变,增大压强平衡不移动,c(CO)/c(CO2)的值不变,故C错误; 恒温恒容,充入一定量氮气,c(CO)、c(CO2)不变,平衡不移动,c(CO)/c(CO2)的值不变,D错误;答案为:A;④Q=2.0/1.4=1.43<K=2.5
反应向正反应方向进行,则原因为由于Q<K则平衡向正反应方向进行。
考点:考查化学反应速率的计算,化学平衡的计算,化学平衡的移动等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3- C.MnO4- D.HNO3
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
某物质熔融状态可导电,固态可导电,将其投入水中溶液也可导电,推测该物质可能是
A.金属 B.非金属 C、可溶性碱 D、可溶性盐
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
在密闭容器中A与B反应生成C,其反应速率分别为 、
、 、
、 表示。已知: 2
表示。已知: 2 =3
=3 ,3
,3 =2
=2 ,则此反应可表示为( )
,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
当光束通过下列分散系,能观察到丁达尔现象的是( )
① 有尘埃的空气 ②稀盐酸 ③蒸馏水 ④墨水
A.②③ B.①④ C.③④ D.① ②③④
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
为减缓足量的镁和一定量盐酸的反应速率,又不影响氢气的总量,可采用的措施是( )
A.加固体NaOH B.加固体硝酸钠 C.加固体醋酸钾 D.加硫酸
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)  2C(g)+D(g) 已达平衡状态的是( )
2C(g)+D(g) 已达平衡状态的是( )
A.混合气体的压强 B.混合气体的密度
C.B的生成速率与D的消耗速率之比为3:1 D.气体的总物质的量
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)
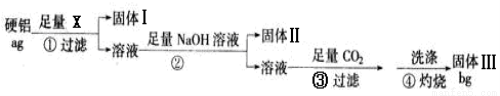
(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择 (填“NaOH溶液”,“盐酸”,“FeCl3溶液”);步骤②的操作是 ,反应的离子方程式为 , 。
(2)固体Ⅲ的化学式为 步骤④反应的化学方程式为 。
(3)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果 (填“偏高”“偏低”“不影响”)
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。根据图示判断,下列结论中不正确的是( )。

A.N点时溶液中的溶质只有NaCl
B.M点之前加入的是NaOH溶液,M点之后加入的是盐酸
C.c(NaOH)=c(HCl)
D.原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com