
(8分)【化学-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(2)CH4与 (写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式 。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为 。
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:2008年普通高等学校招生统一考试化学试题(广东卷) 题型:填空题
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
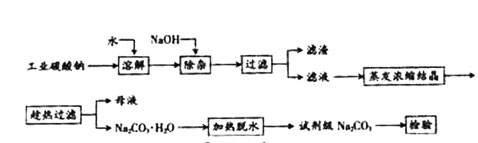
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
【小题1】(1)滤渣的主要成分为 。
【小题2】(2)“趁热过滤”的原因是 。
【小题3】(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
【小题4】(4)若“母液”循环使用,可能出现的问题及其原因是 。
【小题5】(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=" +532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=" +473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com