
【题目】25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类不同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
【答案】B
【解析】
A.都存在着水的电离平衡和HCO3-及CO32-的水解平衡。正确;
B.在这两种溶液中都存在着Na+、H+、HCO3-、CO32-、OH-、H2CO3、H2O。种类相同。错误;
C.HCO3-+ H2O![]() H2CO3+OH-; HCO3-、CO32-+H2O
H2CO3+OH-; HCO3-、CO32-+H2O![]() H2CO3-+OH-.水解程度后者大于前者,所以溶液中C(OH-)浓度CO32-大于HCO3-。因为在溶液中c(H+)·c(OH-)=Kw, c(OH-)越大,c(H+)的浓度就越小。故c(H+) 后者小于前者。正确;
H2CO3-+OH-.水解程度后者大于前者,所以溶液中C(OH-)浓度CO32-大于HCO3-。因为在溶液中c(H+)·c(OH-)=Kw, c(OH-)越大,c(H+)的浓度就越小。故c(H+) 后者小于前者。正确;
D.加入NaOH固体,水解平衡CO32-+H2O![]() H2CO3-+OH-逆向移动,c(CO32-)增大。NaHCO3溶液中发生反应NaHCO3+NaOH=Na2CO3+ H2O。c(CO32-)增大。因此c(CO32-)均增大,正确;
H2CO3-+OH-逆向移动,c(CO32-)增大。NaHCO3溶液中发生反应NaHCO3+NaOH=Na2CO3+ H2O。c(CO32-)增大。因此c(CO32-)均增大,正确;
答案选B。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】在一条河边有四座工厂:甲、乙、丙、丁(如图所示),它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种。某环保小组对河水监测时发现:

①甲处河水呈乳白色
②乙处河水有红褐色沉淀
③丙处河水由浑浊变澄清
④丁处河水产生气泡,河水仍澄清
请推断四座工厂排出的废液里含有的物质分别是(填化学式):
甲:___,乙:___,丙:___,丁:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,将0.1 mol 氢气、2.8 g一氧化碳和0.05 mol 氮气的混合气体与足量氧气充分燃烧后,立即将所得混合气体通过足量的过氧化钠粉末,固体质量增加
A.2.8 gB.3.0 gC.7.2 gD.5.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
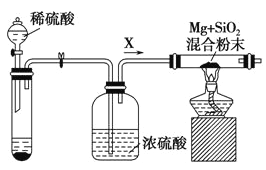
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
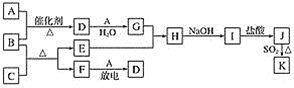
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
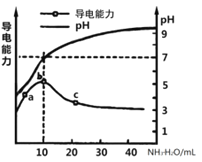
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100mL0.1mol/L的BaCl2溶液与50mL0.2mol/L的NaCl溶液混合,假设混合溶液的体积等于混合前两种溶液的体积之和,则混合溶液中Cl-的浓度是( )
A.0.2mol/LB.0.01mol/LC.0.1mol/LD.0.02mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种绿色能源。如图所示,某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
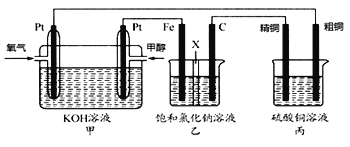
根据要求回答相关问题:
(1)写出负极的电极反应式__________________________________.
(2)铁电极为______(填“阳极”或“阴极” ),石墨电极(C)的电极反应式为______________.
(3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为______g。假设乙装置中溶液足量,若在标准状况下有448mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将增加_______g.
(4)若将乙装置中两电极位置互换,其他装置不变,此时乙装置中发生的总反应式________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 36g由35Cl 和37C1组成的氯气中所含质子数一定为17NA
B. 7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA
C. 密闭容器中1mol PCl3与1 mol Cl2反应制备PCl5(g),增加了2NA个P-Cl键
D. 5.6g铁片投入足量浓硝酸中,转移的电子数为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com