
| A、NaOH、Ca(OH)2、NH3?H2O |
| B、NH4Cl、CH3COOH、Na2S |
| C、HBr、HCl、BaSO4 |
| D、HClO、NaF、Ba(OH)2 |
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| ||
| t/s | 0 | 500 | 1 000 |
| c(H2)/(mol?L-1) | 5.00 | 3.52 | 2.48 |
| c (CO)/(mol?L-1) | 2.50 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3 |
| B、二氧化硫能漂白某些物质,说明它具有氧化性 |
| C、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性 |
| D、实验室可用浓硫酸干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
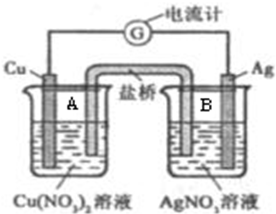 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com