
【题目】(1)完成下列反应的化学方程式
①实验室制Cl2___________________________
②实验室制SO2:__________________________
③实验室制氨气__________________________
④工业上制漂白粉________________________
(2)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(装置可重复选)

①如按气流由左向右流向,连接上述装置的正确顺序是(填甲、乙、丙、丁):___________________;
②有怎样的实验现象才表明已检验出CO2?___________________。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑ Na2SO3+ H2SO4(浓)==Na2SO4+H2O+SO2↑或Cu和浓H2SO4反应也可 2NH4Cl+Ca(OH)2
MnCl2+2H2O+Cl2↑ Na2SO3+ H2SO4(浓)==Na2SO4+H2O+SO2↑或Cu和浓H2SO4反应也可 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑; 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 甲、丙、丁、丙、乙 乙中出现白色沉淀,后一丙中品红未褪色
CaCl2+2H2O+2NH3↑; 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 甲、丙、丁、丙、乙 乙中出现白色沉淀,后一丙中品红未褪色
【解析】试题分析:(1)实验室用二氧化锰和浓盐酸加热制取氯气;用亚硫酸钠与浓硫酸反应制取二氧化硫气体;用氯化铵和氢氧化钙加热制取氨气;用氯气与石灰乳反应制取漂白粉;(2)碳与浓硫酸反应中,会有二氧化硫杂质生成,丁装置主要是除去二氧化硫,丙装置主要是验证二氧化硫及验证二氧化硫是否完全除去,乙装置主要是验证产物中是否含有二氧化碳。用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认。
解析:(1)①二氧化锰和浓盐酸反应生成氯气、氯化锰,反应方程式为MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
②亚硫酸钠与浓硫酸反应生成二氧化硫气体、硫酸钠和水,反应方程式为Na2SO3+ H2SO4(浓)==Na2SO4+H2O+SO2↑;
③氯化铵和氢氧化钙加热制取氨气的方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
④氯气与石灰乳反应生成氯化钙、次氯酸钙的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(2)①根据以上分析,按气流由左向右流向,连接上述装置的正确顺序是甲、丙、丁、丙、乙;
②CO2、SO2都能使石灰水变浑浊,所以乙中出现白色沉淀,后一丙中品红未褪色才表明已检验出CO2。


科目:高中化学 来源: 题型:
【题目】二甲醚与乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列方法中不能对二者进行鉴别的是
A. 利用金属钠 B. 利用红外光谱法
C. 利用质谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的类别的说法不正确的是
A.能在水溶液中或熔融状态下导电的化合物就是电解质
B.胶体是一种能产生丁达尔效应的分散系
C.纯碱不属于碱,干冰属于酸性氧化物
D.Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-C3H7和-C3H7O取代苯环上的氢原子,形成的有机物中能与金属钠反应的同分异构体有
A. 10种 B. 15种 C. 30种 D. 36种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
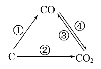
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)===CO2(g)ΔH1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)===CO(g)+H2(g)ΔH2>0;②
再燃烧水煤气:2CO(g)+O2(g)===2CO2(g)ΔH3<0,③
2H2(g)+O2(g)===2H2O(g)ΔH4<0。④
则途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正____v逆(填“>”“<”或“=”)。
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的ΔH=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ·mol-1,
则O3转化为O2的热化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应3X(g)+Y(g)![]() 2Z(g)达到平衡的标志是:
2Z(g)达到平衡的标志是:
A.单位时间内生成3nmolX,同时生成nmolY
B.2v逆(Y)=v正(Z)
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数比为3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
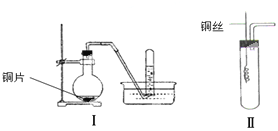
(1)铜与稀硝酸反应的化学方程式_____ _ 。
(2)学生甲用装置Ⅰ探究铜与稀硝酸反应的气体产物。实验过程在烧瓶中观察到有红棕色气体产生,在试管中收集到无色气体。 烧瓶中产生红棕色气体的原因是
(用方程式表示)。
(3)学生乙认为,甲用装置Ⅰ实验,无法说明问题。为了证明并观察到铜与稀硝酸反应的产物为NO,甲设计了如图Ⅱ所示的实验装置,选择下列药品,并按下列实验步骤完成该实验。请你根据他的思路,回答下列问题:
药品:稀硝酸锌粒石灰石固体
步骤:
①检查装置的气密性
②向试管中加入一定量CaCO3固体
③向试管中倒入过量的稀HNO3并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将导管插入试管内接近液面
⑤将铜丝插入到溶液中
⑥用注射器的针头穿过橡皮塞并向试管内推入氧气(或空气)
(ⅰ)步骤②目的是 ;
(ⅱ)推入氧气或空气的目的是 ;
(ⅲ)分别将等质量的铜片与等体积均过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出,这可能是Cu2+的浓度差异引起的,你同意这种看法吗?(填“同意”或“不同意”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石广泛用于生产PVC、维尼纶等,电石与水反应所得残渣——电石渣,主要含Ca(OH)2、CaCO3及少量其他杂质。某工业电石渣的几种回收利用流程如下:
几种物质在水中的溶解度曲线如右图。回答下列问题:
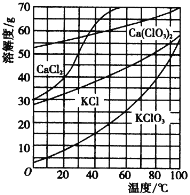
(1)常温氯化
①反应的化学方程式是 。
②提高Cl2转化为Ca(ClO)2的转化率可行的措施有_______(填序号)。
A.加热升高温度 B.适当减缓通入Cl2速率
C.充分搅拌浆料 D.加水使Ca(OH)2完全溶解
③电石渣中的有害杂质CN-与ClO-反应转化为两种无害的气体,每转化1 mol CN-至少需要消耗氧化剂ClO-_______mol。
(2)75 ℃氯化
①生成氯酸钙中氯的化合价为 ,氯化完成后过滤,滤渣的主要成分为______(填化学式)。
②氯酸钙能与KCl反应转化为氯酸钾的原因是 。
(3)有机反应
首先生成氯代乙醇,其结构简式为 ,氯代乙醇再与Ca(OH)2反应生产环氧乙烷。总反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
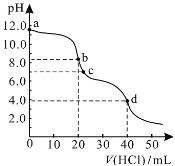
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com