
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中只含有共价键 |
分析 该物质的结构和氯化铵相似,所以其性质和氯化铵相似,氯化铵的构成微粒是阴阳离子,属于离子化合物;不稳定,受热易分解,能和碱反应,据此分析解答.
解答 解:该物质的结构和氯化铵相似,所以其性质和氯化铵相似,氯化铵的构成微粒是阴阳离子,属于离子化合物;不稳定,受热易分解,能和碱反应,
A.根据氯化铵知,该物质的构成微粒是阴阳离子,属于离子化合物,故A错误;
B.该物质性质不稳定,受热易分解生成膦和HI,故B正确;
C.这种化合物能和碱反应生成膦,故C错误;
D.该化合物中阴阳离子之间存在离子键,故D错误;
故选B.
点评 本题考查物质性质,侧重考查学生知识迁移能力,根据氯化铵性质采用知识迁移的方法分析该物质即可,题目难度不大,易错选项是A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷易液化 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的酸性比HBr强 | |
| B. | 次氯酸的氧化性比次溴酸强 | |
| C. | 氯化氢比溴化氢的热稳定性好 | |
| D. | 氯原子最外层电子数比溴原子最外层电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
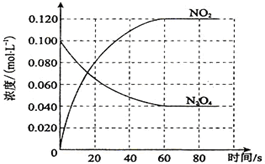 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2 (g),随温度升高,混合气体的颜色变深.反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol/(L•s).
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2 (g),随温度升高,混合气体的颜色变深.反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
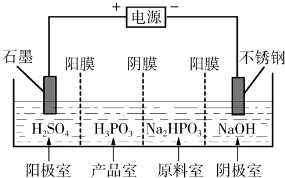
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com