
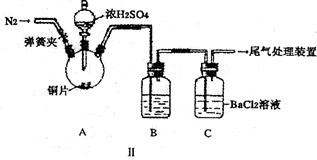
| A.无沉淀生成 |
| B.肯定没有BaSO3生成 |
| C.得到的沉淀是纯净物 |
| D.得到的沉淀是BaSO4和BaSO3组成的混合物 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:不详 题型:实验题

| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含1 mol H2SO4的浓硫酸中有n(H+)=2n(SO42-)=2 mol |
| B.含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子为2 mol |
| C.配制2.0 mol·L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) |
| D.用铜电极电解2.0 mol·L-1的硫酸,阴阳两极生成气体的体积之比为2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2能使品红溶液褪色是因为SO2具有氧化性,所以它也能使酸碱指示剂褪色 |
| B.硫化氢中硫显最低价态-2价,因此只具有还原性 |
| C.浓硫酸使木棒或棉花变黑,体现了浓硫酸的吸水性 |
| D.BaSO4可作“钡餐”进行X射线检查 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨溶于水的喷泉实验,说明氨气极易溶于水 |
| B.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| C.浓硝酸久置显黄色,说明浓硝酸具有不稳定性 |
| D.向胆矾中加入浓硫酸后出现白色的现象,说明浓H2SO4具有吸水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 |
| B.硫粉在过量的氧气中燃烧可以生成SO3 |
| C.将少量SO2通入BaCl2溶液能生成白色沉淀 |
| D.将浓盐酸、浓硝酸和浓硫酸分别露置在空气中,溶质的物质的量浓度都降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用作“钡餐”的物质主要成分是硫酸钡 |
| B.采用催化设施,将汽车尾气中CO和NO转化为无害气体 |
| C.常温下,可以用铁制容器来盛装冷的浓硫酸 |
| D.SO2具有氧化性,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 | | | | |
| 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
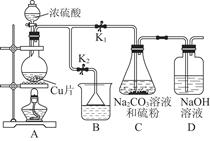
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com