
分析 ①实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
②取碱液过程中眼睛应注视碱式滴定管刻度;
③根据c(待测)=$\frac{C(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断.
解答 解:①在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂,将物质的量浓度为c的标准硫酸溶液装入酸式滴定管.调整液面记下开始读数为V1mL,在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E,
故答案为:CABDE;
②取碱液过程中眼睛应注视碱式滴定管刻度,
故答案为:碱式滴定管刻度;
③滴定操作中,锥形瓶残留少量蒸馏水,对V(标准)无影响,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,测定结果无影响,测得的结果不变,
达到滴定终点时,尖嘴处尚有一滴液滴未滴下,标准溶液体积增大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,测得的结果偏大,
故答案为:不变; 偏大;
点评 本题考查了探究烧碱样品的纯度的方法,涉及酸碱中和滴定、质量分数的计算、化学实验基本操作方法的判断等知识,注意掌握中和滴定操作方法,试题培养了学生的分析能力及化学计算、化学实验能力,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
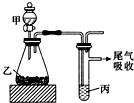 用如图装置进行实验,下列所得结论正确的是( )
用如图装置进行实验,下列所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的ECC水泥是最新研制出来的,其最明显的特征是可以在弯曲状态下承受相当大的压力,因为材料里面有特殊制成的聚合体纤维微粒,所以ECC水泥可以在承受较大压力的状态下弯曲而不破裂.则聚合体纤维微粒在该材料中的作用是( )
如图所示的ECC水泥是最新研制出来的,其最明显的特征是可以在弯曲状态下承受相当大的压力,因为材料里面有特殊制成的聚合体纤维微粒,所以ECC水泥可以在承受较大压力的状态下弯曲而不破裂.则聚合体纤维微粒在该材料中的作用是( )| A. | 做粘合剂,起粘合作用 | B. | 做增强体,起骨架作用 | ||
| C. | 做导电体,起导电作用 | D. | 做原子晶体,起耐热作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用聚二氧化碳塑料会产生白色污染 | |
| B. | 聚二氧化碳塑料是通过聚合反应制得的 | |
| C. | 聚二氧化碳塑料与干冰互为同分异构体 | |
| D. | 聚二氧化碳塑干冰都属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: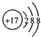 | |
| B. | 聚丙烯的结构简式: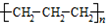 | |
| C. | 三氟化氮的电子式: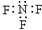 | |
| D. | 熔融硫酸氢钾电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO 和CO2 | D. | NO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
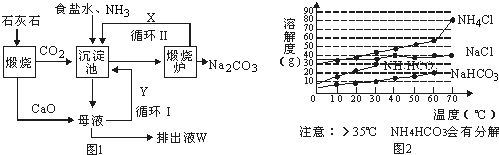
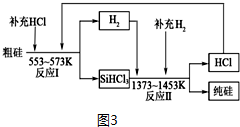
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com