
(5分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题: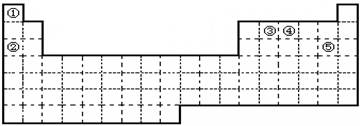
(1)上述五种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中加热的化学方程式为 。
(2)元素①和④形成化合物的电子式是 ,其水溶液呈 (填“碱性”、“酸性”或“中性”)。
(3)试用电子式表示元素⑤单质分子的形成过程 。
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
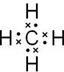

查看答案和解析>>
科目:高中化学 来源: 题型:
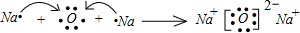
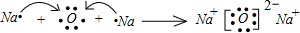


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com