
分析 (1)乙烯和溴的四氯化碳溶液发生加成反应,生成1,2-二溴乙烷;
(2)乙烷与氯气在光照条件下发生取代反应,第一步反应生成氯乙烷;
(3)发生氧化反应生成乙酸、氧化亚铜和水;
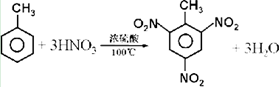
(4)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水;
(5)乙醛和氢气发生加成反应生成乙醇;
(6)碳化钙与食盐水反应制备乙炔;
(7)乙醇和浓H2SO4共热至170℃时发生消去反应,生成乙烯.
解答 解:(1)乙烯和溴的四氯化碳溶液发生加成反应,方程式为:Br2+CH2=CH2→BrCH2-CH2Br;
故答案为:Br2+CH2=CH2→BrCH2-CH2Br;
(2)乙烷和氯气在光照条件下发生的第一步取代反应生成氯乙烷和氯化氢,方程式:C2H6+Cl2$\stackrel{光照}{→}$C2H5Cl+HCl,故答案为:C2H6+Cl2$\stackrel{光照}{→}$C2H5Cl+HCl;
(3)在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
(4)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水,方程式:: ,
,
故答案为: .
.
(5)乙醛和氢气在催化剂作用下反应的化学方程式为CH3CHO+H2$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:CH3CHO+H2$\stackrel{催化剂}{→}$CH3CH2OH;
(6)碳化钙与食盐水反应制备乙炔,该反应为CaC2+2H2O=Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(7)乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,反应方程式为CH3CH2OH$→_{△}^{浓硫酸}$CH2═CH2↑+H2O,
故答案为:CH3CH2OH$→_{△}^{浓硫酸}$CH2═CH2↑+H2O.
点评 本题考查有机化学反应方程式书写,为高频考点,把握有机物的结构与性质、官能团与性质的关系为解答的关键,注意有机反应类型及反应条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
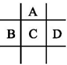
 的正确命名为( )
的正确命名为( )| A. | 3,3,4-三甲基已烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2-乙基-3,3-二甲基-4-乙基戊烷 | D. | 2,3,3-三甲基已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与金属钠反应时,键①断裂 | |
| B. | 与HCl反应生成氯乙烷时,键②断裂 | |
| C. | 与醋酸、浓硫酸共热时,键②断裂 | |
| D. | 与浓硫酸共热至170℃时,键②和④断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 | B. | HC≡C-CH3 | C. | CH3-C≡C-CH3 | D. | CH2═CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | X2Z与X2M比较,稳定性:X2Z>X2M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
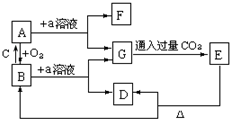 A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.
A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com