
【题目】我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示)。下列做法与上述理念相违背的是( )

A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的5倍,G的3d轨道有3个未成对电子,请回答下列问题:
(1)F的基态原子电子排布式为 ,G在周期表的位置 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答),A、C、D形成的离子化合物中的化学键类型 。
(3)下列关于B2A2(B原子最外层满足8电子稳定结构)分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)用电子式表示E的氯化物的形成过程 。
(5)F的最高正价为+6价,而氧原子最多只能形成2个共价键,试推测CrO5的结构式________。
(6)C的最低价的氢化物为CH3,通常情况下,G2+的溶液很稳定,它与CH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[G(CH3)6]3+,该反应的离子方程式是 ,1 mol [G(CH3)6]3+配离子含有σ键数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为______,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2分子的立体构型为V形
B. ClO3—的空间构型为平面三角形
C. SF6中有每个原子均满足最外层8电子稳定结构
D. SiF4和SO32—的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
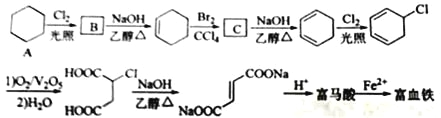
回答下列问题:
(1)A的化学名称为_____;由A生成B的反应类型为_____。
(2)C的结构简式为_____。
(3)富马酸的结构简式为_____。
(4)检验富血铁中是否含有Fe3+的实验操作步骤是_____。
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出____L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有____________(写出结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5·H2O和Fe3O4。
(1)铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。
(2)以硼酸为原料可制得NaBH4 ,B原子的杂化方式为 。
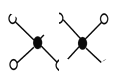
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4)Al单质为面心立方晶体,其晶胞的边长a=0.405nm,列式表示Al单质的密度:____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2) 与NO![]() 等电子体的分子 ,根据等电子体原理在NO
等电子体的分子 ,根据等电子体原理在NO![]() 中氮原子轨道杂化类型是__________;O
中氮原子轨道杂化类型是__________;O![]() 与N2是等电子体,1 mol O
与N2是等电子体,1 mol O![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(4)O3分子是否为极性分子?__________。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-===5I-+IO3-+3H2O
KI+I2![]() KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显血红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显血红色,该红色物质是______(用化学式表示);CCl4中显紫红色的物质是______(用电子式表示)。
②第二份试剂中加入足量KI固体后,反应的离子方程式为__________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:__________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?____(填“是”或“否”),并说明理由:_________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是

________。
A.Na2S2O3 B.AlCl3C.Na2CO3D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
B.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C.利用油脂在碱性条件下的水解,可以制甘油和肥皂
D.植物油和矿物油都不能使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com