为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
(1)汽车内燃机工作时会引起N
2和O
2的反应:N
2(g)+O
2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.
①在T
1、T
2温度下,一定量的NO发生分解反应时N
2的体积分数随时间变化如图1所示,根据图象判断反应N
2(g)+O
2(g)?2NO(g)的△H
0(填“>”或“<”).

②在T
3温度下,向2L密闭容器中充入10mol N
2与5mol O
2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N
2)=
.该温度下,若开始时向上述容器中充入N
2与O
2均为1mol,则达到平衡后N
2的转化率为
.
(2)利用图2所示装置(电极均为惰性电极)可吸收SO
2,用阴极排出的溶液可吸收NO
2.
①阳极的电极反应式为
.
②在碱性条件下,用阴极排出的溶液吸收NO
2,使其转化为无害气体,同时有SO
32-生成.该反应中氧化剂与还原剂的物质的量之比为
.
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol?L
-1的醋酸与b mol?L
-1 Ba(OH)
2溶液等体积混合,充分反应后,溶液中存在2c(Ba
2+)=c(CH
3COO
-),则该混合溶液中醋酸的电离常数Ka=
(用含a和b的代数式表示).




 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案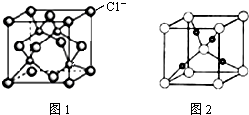 我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用.
我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用. 四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.
四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.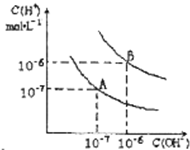 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: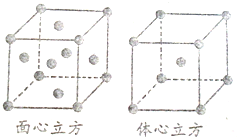 (1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为
(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为