
����Ŀ��

��1��������A(C4H10O)��һ���л��ܼ���A���Է������±仯��
��A�����еĹ�����������____________��
��Aֻ��һ��һ��ȡ����B��д��A�Ľṹ��ʽ��____________��
��A��ͬ���칹��FҲ�����п�ͼ��A�ĸ��ֱ仯����F��һ��ȡ���������֣�F�Ľṹ��ʽ��
______________________________________��
��2�������HQ��(C6H6O2)��������Ӱ������HQ�����������Ȼ�����Һ������ɫ��Ӧ����HQ�����ܷ����ķ�Ӧ��(ѡ�����)____________________��
�ټӳɷ�Ӧ����������Ӧ���ۼӾ۷�Ӧ����ˮ�ⷴӦ[
��HQ����һ����ȡ����ֻ��һ�֡���HQ���Ľṹ��ʽ��______________________��
��3��A�롰HQ����һ��������������γ�ˮ��һ��ʳƷ����������TBHQ������TBHQ��������������Һ���õõ�����ʽΪC10H12O2Na2�Ļ������TBHQ���Ľṹ��ʽ��____________________��
���𰸡���1�����ǻ��� ��
��![]()
��2��������![]()
��3�� 
��������
���������A�ܺ��Ʒ�Ӧ����A�ķ�����ֻ��һ����ԭ�ӣ���˵��A�к����ǻ���Ϊ������Aֻ��һ��һ��ȡ����B������ֻ��1��Hԭ�ӣ���AΪ ��BΪ
��BΪ ���ڼ��ȡ�Ũ���������������£�A�ܷ�����Ӧ����D��D�ܺ��巢���ӳɷ�Ӧ����E����D�к���̼̼˫������A������ȥ��Ӧ����D����D�Ľṹ��ʽΪ��
���ڼ��ȡ�Ũ���������������£�A�ܷ�����Ӧ����D��D�ܺ��巢���ӳɷ�Ӧ����E����D�к���̼̼˫������A������ȥ��Ӧ����D����D�Ľṹ��ʽΪ��![]() ��E�Ľṹ��ʽΪ��CH2BrCBr(CH3)2��
��E�Ľṹ��ʽΪ��CH2BrCBr(CH3)2��
��1����������������֪��AΪ �������еĹ����������ǣ��ǻ���
�������еĹ����������ǣ��ǻ���
��AΪ(CH3)3COH��
��A��ͬ���칹��FҲ�����п�ͼ��A�ĸ��ֱ仯��˵��F�к����ǻ���F��һ��ȡ���������֣�F�����ж�����3�ֲ�ͬ��Hԭ�ӣ���F�Ľṹ��ʽΪ��![]()
��2����HQ�����������Ȼ�����Һ������ɫ��Ӧ��˵��HQ�к��з��ǻ�����������ʽ֪�����л����к����������ǻ���һ�����������Ծ��зӺͱ��������ʣ��ٱ����ܷ����ӳɷ�Ӧ��ȷ�������л��ﺬ�з��ǻ�������������Ӧ����ȷ�������л����в���̼̼˫�������Բ��ܷ����Ӿ۷�Ӧ�������ܸ��л����в���±ԭ�ӡ��������ļ��ȣ����Բ��ܷ���ˮ�ⷴӦ������ ��HQ����һ����ȡ����ֻ��һ�֣���HQ�������ǻ��ڱ����ϴ������λ�ã���ṹ��ʽΪ��![]() ��
��
��3��A�롰HQ����һ��������������γ�ˮ��һ��ʳƷ����������TBHQ������TBHQ��������������Һ���õõ���ѧʽΪC10H12O2Na2�Ļ������TBHQ���к���2�����ǻ������A����HQ���Ļ�ѧʽ��֪��ӦΪ ��
��![]() ��������ȡ����Ӧ��ȥ1����ˮ���ɡ�TBHQ�����ʡ�TBHQ���ṹ��ʽΪ
��������ȡ����Ӧ��ȥ1����ˮ���ɡ�TBHQ�����ʡ�TBHQ���ṹ��ʽΪ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�(LiH)�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�ա�ij�С����ʹ������װ���Ʊ�LiH���塣
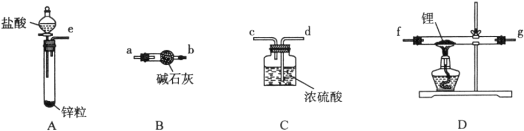
��ͬѧ��ʵ�鷽�����£�
��1����������װ���ӣ���������װ�ýӿڵ�����˳��Ϊ____________________������ҩƷǰ����Ҫ���е�ʵ�������____________________(����д������IJ�������)������װ��B��������________________��
��2������ҩƷ�������Ӵ��Լ�ƿ��ȡ��һ���������(����ʯ���ܷ�)��Ȼ���ڼױ��н�ϴ���Σ��ò�����Ŀ����________________________________________��Ȼ����ٰ�﮷��뵽ʯӢ���С�
��3��ͨ��һ��ʱ�����������ʯӢ�ܣ��ڼ���D����ʯӢ��֮ǰ��������е�ʵ�������______________________________________________________________________��
��4������һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�������ȡ����������Ŀ����Ϊ�˱���LiH������е�ˮ�����Ӵ�������Σ�ա�(��Ӧ����ʽ��
LiH + H2O = LiOH + H2��)�������÷�Ӧԭ�������LiH����ˮ�Ҵ���Ӧ�Ļ�ѧ����ʽ_________________ ___________________��
��5��ȷ�����ƵõIJ�Ʒ0.174g����һ��������������ˮ��Ӧ���ռ�������0.021mol�����Ʒ��LiH��Li�����ʵ���֮��Ϊ____________________��
��6����ͬѧ�Լ�ʵ�鷽��������ɣ�����Ϊδ��Ӧ��H2����ֱ���ŷţ����������������װ��E�����ռ�H2���뽫Eװ�ò���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���Ӧ2SO2+ O2![]() 2SO3���ﵽƽ��ʱ��n(SO2��:n(O2��:n(SO3���� 2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2����0.8mol��n(SO3����1.4mol����ʱSO2�����ʵ���Ӧ��
2SO3���ﵽƽ��ʱ��n(SO2��:n(O2��:n(SO3���� 2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2����0.8mol��n(SO3����1.4mol����ʱSO2�����ʵ���Ӧ��
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�á�
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g����2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��Ӧ��CO2��g����3H2��g��![]() CH3OH��g����H2O��g����H2
CH3OH��g����H2O��g����H2
���������Ʊ��״���������Ӧ�У���Ӧ�����ڷ�Ӧ��ԭ��Ϊ_________________��
�ڷ�Ӧ���У�����H1��0����Ҫ��״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��_____������ĸ��
A����С��������� B�������¶� C�������¶�
D��ʹ�ú����Ĵ��� E�����״��ӻ����ϵ�з������
��2����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l�� ��H1=��1453kJ/mol
��2CO��g��+O2��g��=2CO2��g�� ��H2=��466kJ/mol
��д��32g�״�Һ�巢������ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ�� ��
����CO2��H2�ϳ�CH3OH�ķ�Ӧ���£�CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H����10L�ĺ����ܱ�������Ͷ��1 mol CO2��2.75 mol H2���ڲ�ͬ�����·���������Ӧ�����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
CH3OH��g��+H2O��g����H����10L�ĺ����ܱ�������Ͷ��1 mol CO2��2.75 mol H2���ڲ�ͬ�����·���������Ӧ�����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
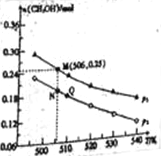
��������Ӧ�ġ�H ���������������0
��ͼ��ѹǿp1 ���������������p2
�۾��ⶨ֪Q��ʱ������ѹǿ�Ƿ�Ӧǰѹǿ��0.9������Ӧ����ʼ��ƽ�������ʱ��Ϊ10min����0~10min��H2�ķ�Ӧ����v(H2)= ��
��N��ʱ���÷�Ӧ��ƽ�ⳣ��K= ������������2λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ʳ�������ˮ�еĵ�Ԫ�ض���NH4+��NH3��H2O����ʽ���ڣ��÷�ˮ�Ĵ����������£�

��1��������:��NaOH��Һ�������������ӷ���ʽ��ʾΪ____________������pH��9��������30����ͨ���������ϳ������գ�
��2��������:���������õ������£�NH4+����������Ӧ��������NO3-��������Ӧ�������仯ʾ��ͼ���£�
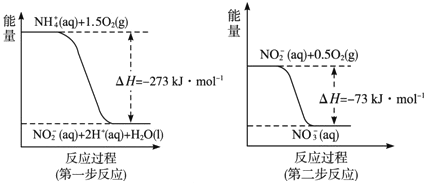
����һ����Ӧ���Ȼ�ѧ����ʽ��____________��
��1molNH4+(aq)ȫ��������NO3-(aq)���Ȼ�ѧ����ʽ��____________��
��3��������:һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32gCH3OHת��6mol���ӣ���÷�Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯������;�㷺������п����п����Ҫ�ɷ���ZnS��Ϊ��Ҫԭ�ϣ��漰����Ҫ��Ӧ�У�
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=��930 kJ��mol��1
H1=��930 kJ��mol��1
2C(s) + O2(g) = 2CO(g) ![]() H2=��221 kJ��mol��1
H2=��221 kJ��mol��1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ��mol��1
H3=198 kJ��mol��1
��ӦZnS(s) + C(s) + 2O2(g)��Zn(g) + CO2(g) + SO2(g)��![]() H4= kJ��mol��1��
H4= kJ��mol��1��
��2����Ӧ�����ɵ�CO2��NH3�������һ�������·�Ӧ�ϳ�������
2NH3��g��+CO2��g��![]() CO��NH2��2��s��+H2O��g����H��0
CO��NH2��2��s��+H2O��g����H��0
���÷�Ӧ��һ���¡������ܱ������ڽ��У��жϷ�Ӧ�ﵽƽ��״̬�ı�־�� ��
a��CO2��H2O(g)Ũ����� b�������������ѹǿ���ٸı�
c��2v(NH3)�� = v(H2O)�� d�������л��������ܶȲ��ٸı�
������߰�����ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��д��������
��3������п�ɹ㷺����ӡȾýȾ����ľ�ķ�������ZnSO4���ȷֽ�����и��������ʵ������¶ȱ仯��ϵ��ͼ��ʾ��
��700����980��ʱ������Ӧ���������ʶ�������ZnO����������÷�Ӧ��2L�ܱ������ڽ��У�10minʱ��������ɵ����������ʵ���Ϊ0.3mol�������ʱ������������������Ϊ ��
�� ����п�ֽ����ɵ�SO2����ͼ�е�ѭ���ɵõ�H2SO4��ѭ���е�����������Ӧʽ�� ��


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҹ�������������ŷŵķ�����ʯ����ȡ���Ტ����ˮ��ļ����о���óɹ�����֪��ʯ����Ҫ�ɷ���Ca3��PO4��2�����������������£�

�ش��������⣺
��1��װ��a����������NH3�����ù�����ʵ�����н��У��뻭��װ��a��ʾ��ͼ��___________��
��2���Ƚ�������ʵ�����Ƚ�����װ�ã���ѧʵ����Ҳ���������Ƚ�����ʵ��ij��ʵ��Ŀ�ģ�������Һ�Ƚ���ʱͨ��ʹ�õ�������___________��
��3��������²����A��һ�����е����ʵĻ�ѧʽ��___________���ᾧˮ���ֲ�д����
��4��������������ŷŵķ�����ʯ����ȡ���ᣬ����SO2��������Ĺ�������ͼ��ͼ��ʾ��

����A�������������������������豸A��������___________���豸A�з�����Ӧ�Ļ�ѧ����ʽ��___________��Ϊ�����������IJ��ʣ��ô�Ӧ����___________���������¹������������ȹ�������Ϊ�ˡ�
����D�����ж��δ�������ԭ����___________��
��B������������Ҫ�ǵ�������������ʱ���徭��C����������D����Ϊ��___________��
��20%�ķ���������SO3����������Ϊ20%��1�����ˮ___________��������2λ��Ч�������������Ƴ�98%�ij�Ʒ���ᡣ
��5����������������β�����˺���N2��O2�⣬������SO2������SO3�������������ڲⶨ����β����SO2��������___________��ѡ����ĸ��
A��NaOH��Һ����̪��Һ
B��KMnO4��Һ��ϡH2SO4
C����ˮ��������Һ
D����ˮ����̪��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ����������֤��ϩ��������Ӧ�����װ�ã���ش��������⣺

��1��������װ��������ȡ��ϩ�����а�����������ҩƷ�ǣ�
�����Ƭ ��ʯ����������̨ ��Բ����ƿ ���¶ȼƣ�����100�������¶ȼƣ�����200�����ƾ��� �ߵ����� ��˫�����ᵼ�ܡ���ѡ�õ������� �����ţ���
д������ϩ��ѧ����ʽ��_____________________________����Ӧ����һ��ʱ�������װ���л��Һ����ڣ������д̼�����ζ������������������� ����Ҫ��֤�и��������ɣ�Ӧ�����ɵ�����ͨ�� ��Һ��
��2��NaOH��Һ��������___________________����ʯ�ҵ������ǣ�_____________________��
��3��ʵ������У�������ˮ����ɫ�����ܵ�ԭ���ǣ�________ _____��
��4������ʲô�����˵�����������飿_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܣ�Co�����仯�����ڹ�ҵ���й㷺Ӧ�á�Ϊ��ij��ҵ�����л����ܣ�ijѧ������������£������к���Al��Li��Co2O3��Fe2O3�����ʣ���

��֪���������ܽ��ԣ�LiF������ˮ��Li2CO3����ˮ��
�ڲ��ֽ��������γ��������������pH���±���
�� | Fe3+ | Co2+ | Co3+ | Al3+ |
pH����ʼ������ | 1.9 | 7.15 | -0.23 | 3.4 |
pH����ȫ������ | 3.2 | 9.15 | 1.09 | 4.7 |
��ش�
��1��������еõ�������Һ�ķ�Ӧ�����ӷ���ʽ ��
��2���������Co2O3�����ᷴӦ�����ӷ���ʽ ��
��3���������Na2CO3��Һ�������ǵ�����Һ��pH��Ӧ������Һ��pH��Χ�� �������е���Ҫ�ɷ�Ϊ ��
��4���������NaF����ķ�Ӧ�Բ���������������
��5���ڿ����м���5.49 g�����ܾ��壨CoC2O4��2H2O����Ʒ��[M(CoC2O4��2H2O) = 183 g/mol ] ���ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������±���
�¶ȷ�Χ/�� | ��������/ g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
���ⶨ��210~290������в���������ֻ��CO2���˹��̷�����Ӧ�Ļ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com