
【题目】为除去下列物质中所含的杂质,所选用的试剂或操作方法错误的是( )
序号 | 物质 | 杂质 | 试剂或方法 |
A |
|
| 加热至恒重 |
B |
|
| 通入过量二氧化碳 |
C |
|
| 加入过量铜粉并过滤 |
D |
|
| 通入氯气 |
A. A B. B C. C D. D
【答案】C
【解析】
本题主要考查除杂试剂的选择以及操作。除杂的原则:(1)不增:不增加新的杂质,(2)不减:被提纯的物质不能减少,(3)易分:操作简便,易于分离,据此分析即可。
A.NaHCO3固体受热分解为Na2CO3、CO2、H2O,除去碳酸氢钠,同时生成碳酸钠,没有引入新杂质,正确;
B.Na2CO3与CO2反应:Na2CO3+CO2+H2O===2NaHCO3,除去Na2CO3,同时生成NaHCO3,没有引入新杂质,正确;
C.加入铜粉,溶液中发生反应:2FeCl3+Cu===2FeCl2+CuCl2,引入新杂质CuCl2,除杂试剂可选用铁粉,错误;
D.通入Cl2,发生反应:2FeCl2+Cl2===2FeCl3,除去FeCl2,同时生成FeCl3,没有引入新杂质,正确。本题选错的,故选C。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别装有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且乙的密度大于甲的密度,下列说法正确的( )
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(DME)-种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al203):2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:

则△H2=____。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的____(填正、负)极,通DME的电极反应为
Ⅱ.2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ/mol(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为

①________________________

(2)T=673K,合成氨反应的热化学方程式为______________
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4C1类似。写出盐酸肼第一步水解反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3—→3
+8HNO3—→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如右图装置的三颈烧瓶中加入16 mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。
请回答下列问题:
(1)装置b的名称为____;滴液漏斗的细支管a的作用是____。
(2)NaOH溶液的作用为____;实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____。
(3)抽滤操作结束时先后进行的操作是______。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或____洗涤晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素及其化合物的转化关系如下图所示:

回答下列问题:
(1)实验室常用下图装置制取并收集氨气,试管中发生反应的化学方程式是_____________。
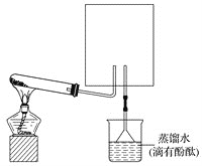
(2)上图中的方框内收集氨气的装置是________(填下图中的字母)。
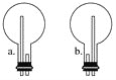
(3)用NH3制取NO的化学方程式是__________________。
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理,完成相应的化学方程式:2NO2+Na2CO3===NaNO2+________+________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在查阅资料时发现,化工厂常用氨气来检验氯气是否泄漏,于是他们设计实验来探究氯气与氨气之间的反应。该小组设计的实验装置如下图

实验可用药品有:a.二氧化锰 b.浓盐酸 c.浓氨水 d.氯化铵 e.碱石灰 f.浓硫酸 g.饱和食盐水 h.NaOH 固体 i.消石灰
请回答下列问题:
(1)实验室制备氨气有多种方法。通常用加热固体混合物的方法制备氨气,反应的化学方程式是_____________,本实验中装置A 烧瓶内的固体可选用_______________(填上述给定药品的序号)。
(2)装置E 的烧瓶中发生反应的离子方程式是_____________________。
(3)装置D 中盛装的药品是________________(填序号),装置C的作用是_________________。
(4)通人B 装置的两根导管左边的较长、右边的较短,其目的是_________________________。
(5)实验中观察到装置B 内出现浓厚的白烟,并在容器壁上凝结成白色固体,白色固体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)调查表明,嘉陵江大桥锈蚀速度每年为0.16mm,远远超过瑞典斯德尔哥尔摩大桥每年0.03mm的锈蚀速率。1982年6月8日,重庆市下了一场大雨,市郊1300多公顷水稻突然枯黄,好像火烧过一样,几天后,局部枯死。上述材料中出现的现象,产生的直接原因是_________________污染问题,在我国,形成该污染的气体主要是_________________。
(2)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应生成CO2和N2。请回答:
① CO与NO反应的化学方程式为_____________________________。
② 控制城市空气污染源的方法可以有_________________(填字母)
a.开发新能源 b.使用电动车 c.植树造林 d.带呼吸面具
(3)垃圾是放错了位置的资源,必须对垃圾进行分类回收。某住宅小区清理出以下垃圾:a.废纸 b.剩菜剩饭、瓜果皮 c.废旧电池 d.废玻璃瓶 e.废橡胶手套 f.一次性塑料饭盒。请用相应的字母填空。
① 其中可投入有![]() 标志垃圾箱的是_________________;
标志垃圾箱的是_________________;
② 其中适宜堆肥处理的垃圾是_________________;
③ 将垃圾按组成材料分类,其中属于硅酸盐材料的是____________;
④随意丢弃_________________,会造成白色污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的有
①17.6g丙烷中所含的共价健数为4 NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5 NA
③电解硫酸铜溶液,往电解后的溶液中加入氧化铜一定可以使溶液恢复到原来的状态
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤1.0L、pH=13的NaOH溶液中,OH-离子数目一定为0.1 NA
⑥将100mL、0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01 NA
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com