
【题目】在组成人体活细胞的化学元素中,质量分数最多的是( )
A. 氧元素 B. 碳元素 C. 氢元素 D. 氮元素
科目:高中化学 来源: 题型:
【题目】氯气与水反应生成的次氯酸具有杀菌作用,常用于自来水的消毒,用此种方法处理的自来水需要经过暴晒后才能用于养金鱼。下列有关说法正确的是
A. 次氯酸中氯元素呈-1价 B. 次氯酸属于电解质
C. 次氯酸的化学性质很稳定 D. Cl2与水的反应中无电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn
B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo
D. N、P、K、Cu、Fe、I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱主要是指含有亚胺或甲亚胺特性基团(-RC=N-)的一类有机化合物,常用作有机合成试剂和液晶材料。通常席夫碱是由胺和活性羰基缩合而成。某席夫碱类化合物G的一种合成路线如下:

已知以下信息
①
②lmol B经上述反应可生成2mol C,且C能发生银镜反应
③D属于单取代芳烃,其相对分子质量为92
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤
回答下列问题
(1)由A生成B的化学方程式为_____________,反应类型为_______________。
(2)D的名称是____________,由D生成E的化学方程式为_______________。
(3)G的结构简式为_______________。
(4)C8H11N的同分异构体中含有苯环的共有_____种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:2:1的是___________(写出其中一种的结构简式)。
(5)上述合成路线,设计一条由苯及化合物C合成乙基苯胺(![]() )的合成路线:_________________________
)的合成路线:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如右图,则原混合溶液中MgCl2与FeCl3的物质的量之比为( ) 
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
A. CO2、H2、CH3OH、H2O的浓度一定相等
B. 该反应已经达到化学平衡状态
C. CO2和H2完全转化为CH3OH和H2O
D. CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用格氏剂制取醇类,格氏试剂(RMgX)的制法是:RX+Mg ![]() RMgX(R为烃基,X为卤素)格氏试剂可发生下列转变:
RMgX(R为烃基,X为卤素)格氏试剂可发生下列转变: 
(R、R′可以是相同或不同的烃基)
以A为原料合成乙酸异丁酯( ![]() )的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
)的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
试回答: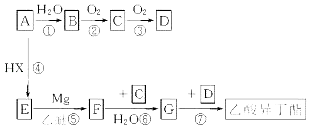
(1)上述流程中,属于或含加成反应的是(填写序号) .
(2)写出F的结构简式 .
(3)写出下列反应的化学方程式:反应① . 反应⑦ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E 为原子序数依次增大的前四周期元素。已知前四种元素的基态原子p能级都有2个单电子,E 的原子序数等于A、B、C三种元素原子序数之和。
试回答下列问题:
(1)基态E原子外围电子排布图为_________;其中M 能层有_____种能量不同的电子。
(2)从原子结构角度解释B 电负性大于D的原因是:_______________。
(3) 含A元素的化合物中,A 的原子间常有π键,但是含C元素的化合物中,C的原子间只能存在σ键,其主要原因是___________________。
(4)H2D2B8是一种具有强氧化性的二元酸(其中分子结构中有2个B原子显-1价),则H2D2B8的结构式为___________,分子中采取sp3杂化的B原子有______个。
(5)E 晶胞内粒子的堆积模型如图所示。

已知:E 晶胞的密度为ρg/cm3,NA代表阿伏加德罗常数值,E 的相对原子质量为M。
①E 粒子的配位数为_______。
②E 粒子半径为_______pm。
③E 晶胞中粒子的空间利用率φ=_____(用含π 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com