
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液
(1)这4种溶液中由水电离的H+浓度最小的是__________。(填序号)
(2)②中各离子浓度由大到小的顺序是_____________,NaHCO3的水解平衡常数Kh=__________mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时![]() 的值__________(填“增大”、“减小”或“不变”)。
的值__________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”之一)。
【答案】① c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—) 2.5×10—8 减小 大于
【解析】
试题本题考查水电离的H+浓度的比较,溶液中离子浓度大小比较,水解平衡常数的计算,外界条件对盐类水解平衡的影响。
(1)①1mol/LH2SO4溶液中c(H+)=2mol/L,H2SO4溶液中OH-全部来自水电离,c(H+)水=c(OH-)水=c(OH-)=1![]() 10-14
10-14![]() 2=5
2=5![]() 10-15(mol/L);②HCO3-的水解程度大于HCO3-的电离程度,溶液呈碱性,NaHCO3溶液中水的电离程度大于纯水;③NH4Cl属于强酸弱碱盐,NH4+的水解促进水的电离,NH4Cl溶液中水的电离程度大于纯水;④1mol/LNaOH溶液中c(OH-)=1mol/L,NaOH溶液中H+全部来自水电离,c(H+)水=c(H+)=1
10-15(mol/L);②HCO3-的水解程度大于HCO3-的电离程度,溶液呈碱性,NaHCO3溶液中水的电离程度大于纯水;③NH4Cl属于强酸弱碱盐,NH4+的水解促进水的电离,NH4Cl溶液中水的电离程度大于纯水;④1mol/LNaOH溶液中c(OH-)=1mol/L,NaOH溶液中H+全部来自水电离,c(H+)水=c(H+)=1![]() 10-14
10-14![]() 1=1
1=1![]() 10-14(mol/L);4种溶液中水电离的H+浓度最小的是①。
10-14(mol/L);4种溶液中水电离的H+浓度最小的是①。
(2)NaHCO3溶液中HCO3-的电离程度(HCO3-的电离方程式HCO3-![]() H++CO32-)小于HCO3-的水解程度(HCO3-的水解方程式HCO3-+H2O
H++CO32-)小于HCO3-的水解程度(HCO3-的水解方程式HCO3-+H2O![]() H2CO3+OH-),溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)
H2CO3+OH-),溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)![]() c(HCO3-)
c(HCO3-)![]() c(OH-)
c(OH-)![]() c(H+)
c(H+)![]() c(CO32-)。NaHCO3的水解平衡常数Kh=
c(CO32-)。NaHCO3的水解平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =2.5
=2.5![]() 10-8mol/L。
10-8mol/L。
(3)在NH4Cl溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,水解平衡常数为
NH3·H2O+H+,水解平衡常数为![]() ,通入少量氨气,c(H+)减小,水解平衡常数不变,
,通入少量氨气,c(H+)减小,水解平衡常数不变,![]() 增大,则
增大,则![]() 减小。
减小。
(4)NH4Cl溶液呈酸性,NaOH溶液呈碱性,③和④若等体积混合恰好完全反应生成NaCl和NH3·H2O,溶液呈碱性;③和④混合后溶液呈中性,则混合前③的体积大于④的体积。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在同种物质的同种元素之间的是( )
A. 2H2S+SO2=3S+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以化工厂铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如下:
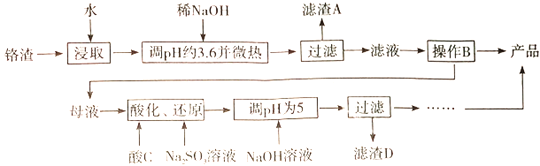
已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
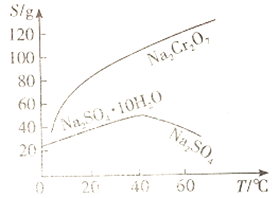
(1)根据下图信息,操作B的最佳方法是_______________________。
(2)“母液”中主要含有的离子为_________________。
(3)酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为______________。
(4)酸化、还原操作时,酸C和Na2SO3溶液是____________(填“先后加入”或“混合后加入”),理由是___________________________。
(5)若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为____________。
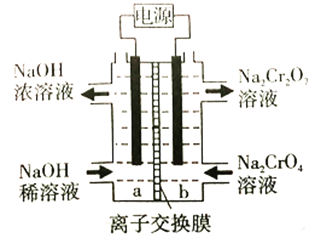
(6)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的____________极相连,其电极反应式为____________。透过交换膜的离子为____________,该离子移动的方向为____________ (填“a→b”或“b→a”)。
Cr2O72-+H2O设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的____________极相连,其电极反应式为____________。透过交换膜的离子为____________,该离子移动的方向为____________ (填“a→b”或“b→a”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH相同的下列溶液中:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)相对大小为(用序号回答)_______________。
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸溶液等体积混合,所得溶液呈中性。用含a的代数式表示一水合氨的电离平衡常数Kb=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是
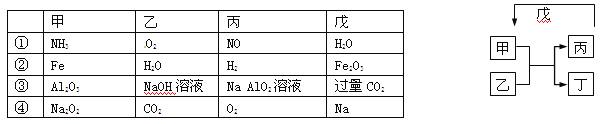
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)顺铂(化学名称为顺二氯二氨合铂(Ⅱ),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g,那么一片顺铂药片中N原子的物质的量____;
(2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为__ g.L-1;(已知:标准状况下,Vm=22.4L·mol-1 )
(3)现有一种矿泉水样品,1.0升的该矿泉水含有4.8×10-2g Mg2+,则__升矿泉水中含有1mol Mg2+;
(4)某“84消毒液”1000mL,其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/mL,其溶质的物质的量浓度为___;
(5)已知CO和CO2的混合气体7.2g,在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为________;
(6)如图所示两瓶体积相等的气体,在同温同压下,若瓶1两种气体____________(填“物质的量”或者“质量”)相等,则两瓶中的气体原子总数和质量均相等。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列反应中的氧化剂和还原剂,写出发生氧化反应和还原反应的物质中对应元素的名称:
(1)2KMnO4![]() K2MnO4+MnO2+O2↑,___________
K2MnO4+MnO2+O2↑,___________
(2)2KNO3+3C+S![]() K2S+3CO2↑+N2↑,_________
K2S+3CO2↑+N2↑,_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com