
【题目】A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍。C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式)______,E、F、L所形成的简单离子的半径由小到大的顺序为(用离子符号表示)_____。
(2)由L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为____。
(3)少量固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有淡黄色沉淀产生,并无气泡冒出,请结合信息写出该反应的离子方程式 _____________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为_______
【答案】SiH4 r(Al3+)< r(Na+)< r(S2-) ![]() Na2O2+2H2O+S2-=S↓+2Na++4OH- (NH4)2C2O4
Na2O2+2H2O+S2-=S↓+2Na++4OH- (NH4)2C2O4
【解析】
根据题干信息中核外电子排布情况等分析元素的种类,根据元素周期律比较氢化物的稳定性及离子半径大小;根据物质性质书写对应离子方程式。
F的质子数比D多5,D的最外层电子数是F的2倍,则D应该是第二周期元素,F应该是第三周期元素。设F的最外层电子数是x,则D的最外层电子数就是2x,因此有关系式10+x-2-2x=5,解得x=3,则D是氧元素,F是Al。C、D、F三种元素的原子序数之和为28,C和D的最外层电子数之和为11,因此C的原子序数是28-8-13=7,C的最外层电子数为11-6=5,即C是氮元素。D与L属于同主族,且L的原子序数大于D的,因此L是S元素,I的原子序数最大,则I是氯元素。由于九种主族元素分布在三个不同的短周期,所以A是氢元素。A与E同主族,则根据E的原子序数大于氧元素的可知,E是Na。G的原子序数只能是14或15,则根据B和G属于同主族且B的原子序数小于氮元素的可知,G不是P,应该是Si,则B是碳元素;
(1)非金属最弱的是硅,所以气态氢化物稳定性最弱的是硅化氢;电子层越多离子半径越大,电子层结构相同核电荷数越大离子半径越小,故答案为: SiH4 ; r(Al3+)< r(Na+)< r(S2-)
(2)氯和硫两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,X的分子式为S2Cl2,电子式为:![]() ;
;
(3)固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S↓+2Na++4OH-;
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y是草酸铵,化学式为:(NH4)2C2O4。


科目:高中化学 来源: 题型:
【题目】向纯水中加入少量的盐酸(温度不变),则下列说法正确的是( )
A.促进了水的电离B.c(H+)减小
C.水中c(H+)与c(OH-)的乘积增大D.c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列微粒的电子式:
(1)NH4+:____________; CO2:__________;NaOH:________________ 。
(2)若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ。则此反应的热化学方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置___________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:_____________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式________________,这一反应是___________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉 淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正 确的是

A. O~A段反应的化方程式是Ba(OH)2+CO2=BaCO3↓+H2O
B. B~C段反应的离子方程式是2AlO2- +3H2O+CO2=2Al(OH)3↓+CO32-
C. A~B段与C~D段所发生的反应相同
D. D~E段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X位于Y的下一周期,X、Y的原子序数均不大于20.某含氧酸盐甲的化学式 为XYO3。请回答:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,一种是 含Y元素的无氧酸盐,则X位于周期表_____,甲发生分解反应的化学方程式是_____。
(2) 若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为_____(填化学式)该气体能使酸性高锰酸钾溶液褪色, 该反应的离子方程式为_____;
②X、Y形成简单离子半径大小关系为 > (用离子符号表示)._________
③25℃时,甲在水中的沉淀溶解平衡曲线如右图所示,若要使溶液 X2+离子沉淀完全,则 YO32-离子的最小浓度为_____mol·L-1。
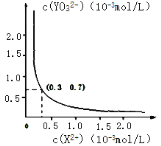
(当离子浓度小于 1×10-5mol·L-1 时,该离子沉淀完全)
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙的电子式为_____;
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图。下列说法错误的是( )

A. 若图1表示正常细胞中化合物含量,则A、B共有的元素中在活细胞中含量最多的是图2中的a
B. 若图1表示干细胞中化合物含量,则A中含量最多的元素为图2中的b
C. 若图1表示正常细胞中化合物含量,则B具有多样性,其必含的元素为C、H、O、N
D. 细胞中含量最多的元素是图2中的a,数量最多的也是a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是制造燃料电池的重要原料,工业上用CH4和H2O为原料来制备甲醇。
(1)将2.0 molCH4和3.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如下图。
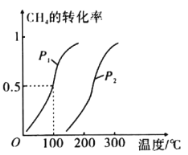
①已知压强为p1,100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_________。
②图中的p1_______ p2(填“<”“>”或“=”),100℃时平衡常数为_______________。
③在其他条件不变的情况下降低温度,重新达到平衡时H2体积分数将________________(填“增大”“减小”或“不变”)
(2)在压强为0.1MPa条件下,将 amolCO与2 amolH2的混合气体在催化剂作用下能自发反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H________0,△S_________0(填“<”“>”或“=”)
②若容器容积不变,下列措施可提高H2转化率的是__________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.再充入2 molCO和2molH2 D.充入He,使体系总压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com