
【题目】保护环境日益引起人们的重视。下列做法有利于保护环境的是( )
A. 氢能源代替化石能源
B. 推广使用太阳能电池
C. 电动汽车代替燃油汽车
D. 造纸厂污水直接排放
科目:高中化学 来源: 题型:
【题目】冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:

下列有关冰晶胞说法正确的是
A. 冰晶胞内水分子间以共价键结合
B. 每个冰晶胞平均含有4个水分子
C. 水分子间的氢键具有方向性和饱和性,也是σ键的一种
D. 实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别
A. 1000mL,117gB. 950mL,111.2 g
C. 任意规格,117gD. 500mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+O2(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是
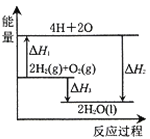
A. H1<0 B. H2为该反应的反应热
C. H1=H3-H2 D. H3为氢气的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸 K1=4.0×10-7 K2=5.0×10-11
亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)常温下,写出碳酸的第一级电离平衡常数表达式K1=__________,则0.50mol/L的Na2CO3溶液的pH=________
(2)等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为_____________。
(3)向0.01molL-1CH3COONa溶液中分别加入少量浓盐酸、Na2CO3固体使水解平衡移动的方向分别为___________、________.(填“左”“右”或“不移动”)
(4)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合混合液中的下列关系式正确的是________。
A.c(CH3COOH)+2c(OH-)=c(CH3COO-)+2c(H+)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.2mol/L
D. c(CH3COOH) > c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
(5)下列离子方程式中错误的是________。
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO![]() +HClO
+HClO
B.少量SO2通入次氯酸钙溶液中:2ClO-+SO2+H2O===SO32-+2HClO
C.Na2CO3溶液中加入足量NaHSO3溶液: CO32-+HSO3-=HCO3-+SO32-
D.少量CO2通入亚硫酸钠溶液中: SO32-+CO2+H2O=HSO3-+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z>H2W
D. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不能加快锌粒与1 molL-1H2SO4反应产生H2的速率的是
A. 用锌粉代替锌粒B. 加少量醋酸钠固体
C. 加少量CuSO4固体D. 改用2 molL-1H2SO4与锌粒反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com