某实验中,用0.1000mol?L
-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准盐酸润洗2-3次后,向其中注入0.1000mol?L
-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数V
1.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V
2.
④重复以上过程2-3次.
试回答下列问题:
(1)滴定到达终点的现象是:
.
(2)该实验操作在步骤①中有一处错误是
此错误会造成的实验测定结果
(填“偏高、偏低、无影响”);下列操作对实验结果的影响和上述错误操作的影响一样的是:
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用标准盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分初读数时有气泡,末读数时气泡消失.
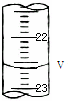
(3)如图,是某次滴定时的滴定管中的液面,其读数为V=
mL.
(4)实验记录
| 序号 | 待测液体积(mL) | 标准盐酸体积(mL) |
| 滴定前读数V1(mL) | 滴定后读数V2(mL) |
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 5.15 | 30.15 |
根据上表数据请计算待测烧碱溶液的浓度为
.



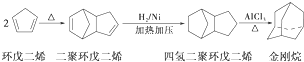
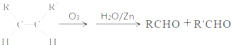 .请写出下列反应产物的结构简式:
.请写出下列反应产物的结构简式: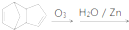
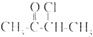
 某实验中,用0.1000mol?L-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下:
某实验中,用0.1000mol?L-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下: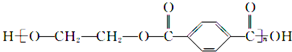 的单体是HOCH2CH2OH与
的单体是HOCH2CH2OH与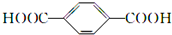
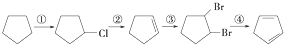
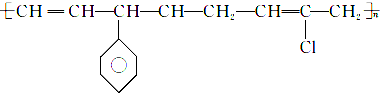 的单体有3种
的单体有3种