
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制
得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450℃~500℃),四氯化硅
经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图:
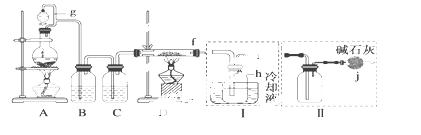
相关信息如下:
①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)装置A中g管的作用是 ;装置C中的试剂是 。
(2)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ。但是装置Ⅰ、Ⅱ都有不足之处,请你评价后填写下表。
| 方案 | 优点 | 缺点 |
| 甲 | ||
| 乙 |
(3)在上述(2)的评价基础上,请你设计一个合理方案并用文字表述: 。
(4)SiCl4与H2反应的化学方程式为 。
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法错误的是 ( )
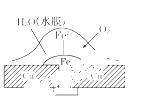 A.正极电极反应式为:2H++2e-===H2↑
A.正极电极反应式为:2H++2e-===H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中Cu并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)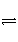
 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
①2 mol C
②2 mol A、1 mol B和1 mol He(不参加反应)
③1 mol B和1 mol C
④2 mol A、3 mol B和3 mol C
A.①② B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液或浊液中,关于离子浓度的说法正确的是
A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:
c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:
c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+)
D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊
液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.高纯度的硅单质广泛用于制作光导纤维
B.化工生产时将氯气通入到饱和的石灰水中可制得大量漂粉精
C.SO2被氧气氧化的条件一般选择高温、高压、催化剂
D.矿青石棉的化学式为:Na2Fe5Si8O22(OH)2改写成氧化物的形式则为Na2O·3FeO·Fe2O3·8SiO2·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中,正确的是(双选)( )
A.二氧化硅和氢氟酸反应:SiO2+4H+===Si4++2H2O
B.二氧化硅和氢氧化钾溶液反应:SiO2+2OH-===SiO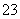 +H2O
+H2O
C.水玻璃中滴入盐酸:SiO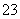 +2H+===H2SiO3↓
+2H+===H2SiO3↓
D.碳酸钡滴加稀硝酸:CO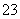 +2H+===H2O+CO2↑
+2H+===H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
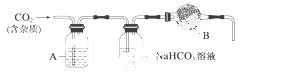
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是_________。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是____________,NaHCO3溶液可以吸收________。
(3)上述装置中,B物质是__________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出_______。
(6)上述测定实验中,连续__________,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:
洪水过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________________。
(2)漂白粉的有效成分是(填名称)________。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为______________________________。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com