
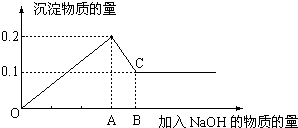
分析 (1)氯化镁和氯化铝均可以和氢氧化钠发生反应,生成沉淀氢氧化镁和氢氧化铝,氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,根据图象可知,在滴加NaOH溶液到加入氢氧化钠为Amol时,沉淀量最大为0.2mol,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液,继续滴加氢氧化钠,但在加入(B-A)mol时,沉淀物质的量最小为0.1mol,是氢氧化镁沉淀,所以加入Amol氢氧化钠时沉淀中有氢氧化镁0.1mol、氢氧化铝0.1mol;此时溶液为氯化钠、偏铝酸钠溶液;
(2)AB段沉淀物质的量最小为0.1mol,故氢氧化铝溶解于氢氧化钠溶液,据此书写方程式.
解答 解:根据图象可知,在滴加NaOH溶液到加入氢氧化钠为Amol时,沉淀量最大为0.2mol,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液.继续滴加氢氧化钠,但在加入(B-A)mol时,沉淀物质的量最小为0.1mol,是氢氧化镁沉淀,所以加入Amol氢氧化钠是沉淀中有氢氧化镁0.1mol、氢氧化铝0.1mol;此时溶液为氯化钠、偏铝酸钠溶液.
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol,C点氢氧化铝完全溶解,Al(OH)3+NaOH═NaAlO2+2H2O,根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,所以溶解氢氧化铝加入的氢氧化钠为0.1mol.
所以加入的氢氧化钠的物质的量为0.5mol+0.1mol=0.6mol;C点氢氧化铝完全溶解,铝元素在溶液中以AlO2-存在,
故答案为:0.6;全部转化为偏铝酸根离子;
(2)AB段,氢氧化铝溶解于氢氧化钠溶液Al(OH)3+NaOH═NaAlO2+2H2O,发生的离子反应方程式为Al(OH)3+OH-═AlO2-+2H2O;
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查镁、铝化合物反应的混合计算,关键是根据图象分析,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
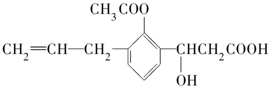 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
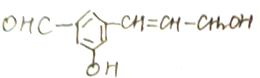 在下列反应中生成的有机物的结构简式.
在下列反应中生成的有机物的结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com