
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)以CO2与NH3为原料合成尿素[CO(NH2)2]的技术已十分成熟。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.47 kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+28.49kJmol-1
③H2O(g)=H2O(l) △H=-88.0kJmol-1
则NH3和CO2合成尿素和气态水的热化学方程式为___。
(2)已知:工业上在120℃条件下利用NH3和CO2合成尿素。在恒温恒容条件下,下列能说明合成尿素反应达平衡的是___
A.NH3和CO2的比例保持不变
B.混合气体的压强不再发生变化
C.2v(NH3)(正)=v(CO2)(逆)
D.混合气体的密度不再改变
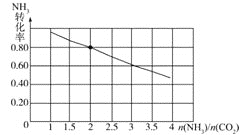
(3)氨碳比[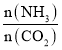 ]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[
]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[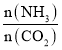 ]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
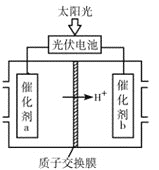
(4)研究人员设计出一种新型太阳能电池,能直接把CO2和H2O转化为CO、H2和O2,原理如图所示,该装置中能量转化方式为___,催化剂b表面的电极反应式为___。
【答案】2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1 BD 3.75 64 太阳能转化为电能,电能转化为化学能 2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)、2H++CO2+2e-=CO+H2O
【解析】
(1)根据盖斯定律进行计算;
(2)根据化学平衡状态判断标准正逆反应速率相等;各组分浓度保持不变及由此衍生的物理量进行分析;
(3)根据三段式进行分析计算转化率及平衡常数;
(4)由图可知,该装置中能量转化方式为太阳能转化为电能,电能转化为化学能;由图可知,催化剂b一侧为正极,氢离子、二氧化碳得电子发生还原反应。
![]() 由热化学方程式和盖斯定律,反应
由热化学方程式和盖斯定律,反应![]() 可得
可得![]() 和
和![]() 合成尿素和气态水的热化学方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1,
合成尿素和气态水的热化学方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1;
![]() 如果
如果![]() 和
和![]() 最初按化学计量数充入,则无论平衡与否,其比例保持不变,故A错误;
最初按化学计量数充入,则无论平衡与否,其比例保持不变,故A错误;
B.在恒温恒容条件下,反应达平衡时混合气体的物质的量不再变化,压强也不再发生变化,故B正确;
C.当![]() 正
正![]() 逆
逆![]() 时反应达平衡状态,故C错误;
时反应达平衡状态,故C错误;
D.达平衡时混合气体的质量不再改变,在恒温恒容条件下密度也不再改变,故D正确,
故选BD;
![]() 根据题意,由三段式:
根据题意,由三段式:![]()
起始量 2x x 0 0
转化量 2 1 1 1
平衡量 ![]()
![]() 1 1
1 1
当![]() 时,由图可知
时,由图可知![]() 的转化率为
的转化率为![]() ,则
,则![]() ,
,![]() ,
,
总物质的量为![]() ,此温度下该反应的化学平衡常数
,此温度下该反应的化学平衡常数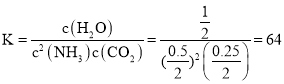 ,
,
故答案为:64;
![]() 由图可知,该装置中能量转化方式为太阳能转化为电能,电能转化为化学能;由图可知,催化剂b一侧为正极,其表面的电极反应式为:
由图可知,该装置中能量转化方式为太阳能转化为电能,电能转化为化学能;由图可知,催化剂b一侧为正极,其表面的电极反应式为:![]() 或
或![]() 、
、![]() ,
,
故答案为:![]() 或
或![]() 、
、![]() 。
。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时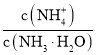 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
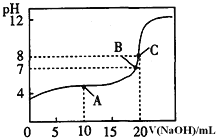
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2S沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )

A.向Cu2+浓度为1×10-5mol·L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出
B.25℃时,Ksp(CuS)约为1×10-35
C.向100mLZn2+、Cu2+浓度均为1×10-5 mol·L-1的混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2= bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=___kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)CO(g)+H2O(g)。
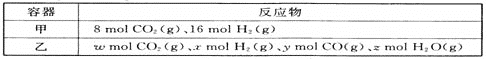
甲容器15min后达到平衡,此时CO2的转化率为75%。此条件下该反应的平衡常数K=___。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如图所示:
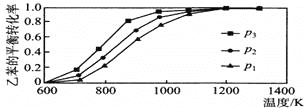
则△H___0(填“>”“<”或“=”),压强力p1、p2、p3从大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:___________________________________。
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
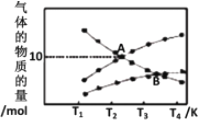
则A点时,NO2的转化率为_______________。
B点时,设容器的总压为a Pa,则平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=____________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3H2O吸收。已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2kJ/mol,中和热ΔH=-57.3kJ/mol则1molNH3H2O理论上完全电离时需要吸收的热量为___。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为47之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式___。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4molSO2,发生SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=-41.8kJ/mol在不同温度下测定同一时刻NO2的转化率,结果如图所示。
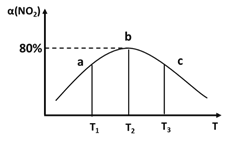
①a、c两点反应速率大小关系:v正(a)___v逆(c)。(填“>”“<”或“=”)
②温度为T2时,该反应的平衡常数为___。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率___(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。

A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量Na2O2和NaHCO3均匀混合物分成质量相等的甲乙两份。将甲投入100mL稀盐酸,固体完全溶解,收集到标况下的干燥气体2.24L。再将生成的气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为2.016L。根据以上信息,下列有关推断不正确的是( )
A. 甲乙两份混合物中均含Na2O2 0.16mol
B. 甲乙两份混合物中均含NaHCO3 0.02mol
C. 原混合物中Na2O2和NaHCO3物质的量之比无法确定
D. 盐酸物质的量浓度可能为3.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com