
Ę½ŗā³£ŹżKCµÄŹżÖµ“󊔣¬ŹĒŗāĮæ»Æѧ·“Ó¦½ųŠŠ³Ģ¶ČµÄ±źÖ¾”£ŌŚ25”ꏱ£¬ĻĀĮŠ·“Ó¦µÄĘ½ŗā³£ŹżČēĻĀ£ŗ
N2(g) + O2(g) ![]() 2NO(g) K1 = 1”Į10£30
2NO(g) K1 = 1”Į10£30
2H2(g) + O2(g) ![]() 2H2O(g) K2 = 2”Į10 81
2H2O(g) K2 = 2”Į10 81
2CO2 (g) ![]() 2CO(g)£«O2(g) K3 = 4”Į10£92
2CO(g)£«O2(g) K3 = 4”Į10£92
£Ø1£©³£ĪĀĻĀ£¬NO·Ö½ā²śÉśO2·“Ó¦µÄĘ½ŗā³£ŹżµÄ±ķ“ļŹ½ĪŖK = ”£
£Ø2£©³£ĪĀĻĀ£¬Ė®·Ö½ā²śÉśO2£¬“ĖŹ±Ę½ŗā³£ŹżÖµŌ¼ĪŖK = ”£
£Ø3£©³£ĪĀĻĀ£¬NO£¬H2O£¬CO2 ČżÖÖ»ÆŗĻĪļ·Ö½ā·Å³öŃõĘųµÄĒćĻņ“óŠ”Ė³ŠņĪŖ ”£
£Ø4£©±±¾©ŹŠÕžø®ŅŖĒóČ«ŹŠ¶ŌĖłÓŠĪ²Ęų“¦Ąķ×°ÖĆĶź³ÉøÄ×°£¬ŅŌĒ󻳱¾ÉĻ³żČ„µŖŃõ»ÆĪļ”¢Ņ»Ńõ»ÆĢ¼ĪŪČ¾ĘųĢåµÄÅÅ·Å£¬¶ųøÄ×°ŗóµÄĪ²Ęų“¦Ąķ×°ÖĆÖ÷ŅŖŹĒ¼ÓČėÓŠŠ§“߻ƼĮ£¬Äćøł¾ŻŅŌÉĻÓŠ¹ŲŹż¾Ż·ÖĪö£¬½öŹ¹ÓĆ“ß»Æ¼Į³żĪŪČ¾ĘųĢåµÄæÉÄÜŠŌ”£
£Ø1£©K=![]() £Ø2£©5”Į10£82 £Ø3£©NO£¾H2O£¾CO2
£Ø2£©5”Į10£82 £Ø3£©NO£¾H2O£¾CO2
£Ø4£©NO”¢COÓėO2·“Ó¦½ųŠŠµÄ³Ģ¶ČŗÜ“ó£¬Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ¼Óæģ·“Ó¦ĖŁĀŹ£¬ŌŚĖ®ÕōĘų“ęŌŚĻĀÉś³ÉHNO3ŗĶCO2£¬Ōņ»ł±¾ÉĻæÉŅŌ³żČ„ĪŪČ¾ĘųĢ唣 »ņÓɵŚ1£¬3øö·“Ó¦¼°Ę½ŗā³£ŹżæÉÖŖ2CO + 2NO=2CO2 + N2µÄK = 1/K1K2 = 2.5”Į10121£¬Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ¼Óæģ·“Ó¦ĖŁĀŹ£¬»ł±¾ÉĻæÉŅŌ³żČ„ĪŪČ¾ĘųĢ唣



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğÕć½Ź”ĢØ֯֊ѧø߶žĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗµ„Ń”Ģā
»ÆŃ§Ę½ŗā³£ŹżKµÄŹżÖµ“󊔏ĒŗāĮæ»Æѧ·“Ó¦½ųŠŠ³Ģ¶ČµÄ±źÖ¾£¬ŌŚ³£ĪĀĻĀ£¬ĻĀĮŠ·“Ó¦µÄĘ½ŗā³£ŹżµÄŹżÖµČēĻĀ£ŗ
2NO(g)  N2(g)£«O2(g)””K1£½1”Į1030
N2(g)£«O2(g)””K1£½1”Į1030
2H2(g)£«O2(g)  2H2O(g)””K2£½2”Į1081
2H2O(g)””K2£½2”Į1081
2CO2(g)  2CO(g)£«O2(g)””K3£½4”Į10£92
2CO(g)£«O2(g)””K3£½4”Į10£92
ŅŌĻĀĖµ·ØÕżČ·µÄŹĒ
| A£®³£ĪĀĻĀ£¬NO·Ö½ā²śÉśO2µÄ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK1£½c(N2)”¤c(O2) |
| B£®³£ĪĀĻĀ£¬Ė®·Ö½ā²śÉśO2£¬“ĖŹ±Ę½ŗā³£ŹżµÄŹżÖµŌ¼ĪŖ5”Į10£80 |
| C£®³£ĪĀĻĀ£¬NO”¢H2O”¢CO2ČżÖÖĪļÖŹ·Ö½ā·Å³öO2µÄĒćĻņÓɓ󵽊”µÄĖ³ŠņĪŖ NO£¾H2O£¾CO2 |
| D£®ŅŌÉĻĖµ·Ø¶¼²»ÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğÕć½Ź”ĢØÖŻŹŠøßČżÉĻѧʌʌĩ֏ĮæĘĄ¹Ą»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
Č¼Ćŗ·ĻĘų”¢Ęū³µĪ²ĘųÖŠµÄµŖŃõ»ÆĪļ£ØNOx£©”¢Ņ»Ńõ»ÆĢ¼µČÓŠŗ¦ĘųĢ壬³£ÓĆĻĀĮŠ·½·Ø“¦Ąķ£¬ŅŌ¼õÉŁ¶Ō»·¾³µÄĪŪČ¾”£
£Ø1£©¶ŌČ¼Ćŗ·ĻĘų½ųŠŠĶŃĻõ“¦ĄķŹ±£¬³£ĄūÓĆ¼×Ķé“߻ƻ¹ŌµŖŃõ»ÆĪļ£¬Čē£ŗ
CH4(g)£«4NO2(g)£½4NO(g)£«CO2(g)£«2H2O(g) ”÷H £½-574 kJ”¤mol-1
CH4(g)£«4NO(g)£½2N2(g)£«CO2(g)£«2H2O(g) ”÷H £½-1160 kJ”¤mol-1
Ōņ1molCH4½«NO2»¹ŌĪŖN2µÄ·“Ó¦ČČĪŖ £»
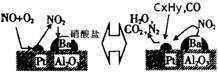
£Ø2£©³żµŖŃõ»ÆĪļ¼°COĶā£¬Ęū³µĪ²ĘųÖŠ»¹ŗ¬ÓŠĢ¼Ēā»ÆŗĻĪļµČĪŪČ¾Īļ£¬ĻĀĶ¼ŹĒĘū³µĪ²Ęų×Ŗ»ÆŃŠ¾æµÄŹ¾ŅāĶ¼£ŗ±ķŹ¾µÄŹĒPt/Al2O3/Ba±ķĆęĪüø½Óė½āĪü×÷ÓƵĻśĄķ£¬µŖŃõ»ÆĪļŹĒNO2£¬Ģ¼Ēā»ÆŗĻĪļŹĒCxHy£¬Š“³öĮ½Õß·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ £¬Pt/Al2O3/BaµÄ×÷ÓĆŹĒ £»
£Ø3£©Ę½ŗā³£ŹżKµÄŹżÖµ“󊔣¬ŹĒŗāĮæ»Æѧ·“Ó¦½ųŠŠ³Ģ¶ČµÄ±źÖ¾£¬KµÄŹżÖµŌ½“󣬻Æѧ·“Ó¦µÄĻŽ¶ČŌ½“󣬷“Ó¦Īļ·“Ó¦µÄŌ½³ä·Ö”£ŌŚ25”ꏱ£¬ĻĀĮŠ·“Ó¦µÄĘ½ŗā³£ŹżČēĻĀ£ŗ
N2(g)£«O2(g) 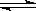 2NO(g) K1£½1”Į10£30 ¢å
2NO(g) K1£½1”Į10£30 ¢å
2H2(g)£«O2(g) 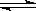 2H2O(g)
K2£½2”Į1081 ¢ę
2H2O(g)
K2£½2”Į1081 ¢ę
2CO2 (g) 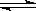 2CO(g)£«O2(g) K3£½4”Į10£92 ¢ē
2CO(g)£«O2(g) K3£½4”Į10£92 ¢ē
 ¢Ł³£ĪĀĻĀ£¬·“Ó¦2H2O(g)
2H2(g) +O2(g) Ę½ŗā³£ŹżK£½ £»
¢Ł³£ĪĀĻĀ£¬·“Ó¦2H2O(g)
2H2(g) +O2(g) Ę½ŗā³£ŹżK£½ £»
¢Ś¹ŲÓŚŅŌÉĻ·“Ó¦£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®³£ĪĀĻĀ£¬NO£¬H2O£¬CO2ČżÖÖ»ÆŗĻĪļ·Ö½ā·Å³öŃõĘųµÄĒćĻņ“óŠ”Ė³Šņ£ŗNO£¾H2O£¾CO2
B£®ČōÉżøßĪĀ¶Č£¬·“Ó¦¢ēµÄĘ½ŗā³£ŹżK3½«Ōö“ó
C£®ČōÖ»Ōö¼ÓŃ¹Ē棬ĒŅ·“Ó¦Īļ”¢Éś³ÉĪļדĢ¬²»±ä£¬·“Ó¦¢åĘ½ŗā²»·¢ÉśŅĘ¶Æ£¬Ę½ŗā³£Źż²»±ä£»·“Ó¦¢ęĘ½ŗā³ÆÕżĻņŅĘ¶Æ£¬Ę½ŗā³£ŹżŌö“ó
D£®ČōŌö¼ÓĘū³µ·¢¶Æ»śæÕĘųµÄ½ųĘųĮ棬æÉĶ¬Ź±¼õÉŁµŖŃõ»ÆĪļŗĶŅ»Ńõ»ÆĢ¼µÄÅÅ·Å
¢Ū»łÓŚ»·±£·Ø¹ę£¬ŅŖĒóøÄ×°Ęū³µĪ²Ęų“¦Ąķ×°ÖĆ£¬“ļµ½Ź¹µŖŃõ»ÆĪļ£ØNO£©”¢Ņ»Ńõ»ÆĢ¼×Ŗ»ÆĪŖĪŽĪŪČ¾”¢æÉÅŷŵÄĘųĢåµÄÄæµÄ”£øÄ×°µÄ·½·ØÖ÷ŅŖŹĒ¼ÓČėÓŠŠ§“߻ƼĮ£¬ĒėÄćøł¾ŻŅŌÉĻÓŠ¹ŲŹż¾Ż·ÖĪö£¬ŌŚ²»øıäĘäĖüĢõ¼žµÄĒéæöĻĀ£¬æÉŹ¹ÓĆ“ß»Æ¼Į³żĪŪČ¾ĘųĢåµÄŌŅņ£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2010Äź½Ī÷Ź”øß°²ÖŠŃ§ø߶žÉĻѧʌµŚČż“Ī¶Īæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗŃ”ŌńĢā
»ÆŃ§Ę½ŗā³£ŹżKµÄŹżÖµ“󊔏ĒŗāĮæ»Æѧ·“Ó¦½ųŠŠ³Ģ¶ČµÄ±źÖ¾£¬ŌŚĶ¬Ņ»Ģõ¼žĻĀ,ĻĀĮŠ·“Ó¦µÄĘ½ŗā³£ŹżµÄŹżÖµČēĻĀ£ŗ
2NO(g)  N2(g)£«O2(g)””K1£½1”Į1030
N2(g)£«O2(g)””K1£½1”Į1030
2H2(g)£«O2(g)  2H2O(g)””K2£½2”Į1081
2H2O(g)””K2£½2”Į1081
2CO2(g)  2CO(g)£«O2(g)””K3£½4”Į10£92
2CO(g)£«O2(g)””K3£½4”Į10£92
ŌŚĶ¬Ņ»Ģõ¼žĻĀ,ŅŌĻĀĖµ·ØÕżČ·µÄŹĒ(””””)
A£® NO·Ö½ā²śÉśO2µÄ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK1£½c(N2)”¤c(O2)
B£®Ė®·Ö½ā²śÉśO2£¬“ĖŹ±Ę½ŗā³£ŹżµÄŹżÖµŌ¼ĪŖ5”Į10£80
C£®NO”¢H2O”¢CO2ČżÖÖ»ÆŗĻĪļ·Ö½ā·Å³öO2µÄĒćĻņÓɓ󵽊”µÄĖ³ŠņĪŖNO£¾H2O£¾CO2
D£®ŅŌÉĻĖµ·Ø¶¼²»ÕżČ·
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com