
【题目】已知H2的燃烧热是akJ/mol,由H2、CO按3:1比例组成的混合物2mol,完全燃烧并恢复到常温吋,放出的热量为bkJ,则CO的燃烧热为(kJ/mol)为( )
A.2b﹣3a
B.3a﹣2b
C.![]() (2b﹣3a)
(2b﹣3a)
D.![]() (a﹣2b)
(a﹣2b)
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,可表明反应:A(g)+B(g)![]() C(g)+D(g) 已达化学平衡状态的是( )
C(g)+D(g) 已达化学平衡状态的是( )
A. 混合气体的压强 B. B的物质的量浓度 C. 混合气体的密度 D. v(A)正 = v(D)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL ﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )

A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( ) 
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c
D.△H<0,a+b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 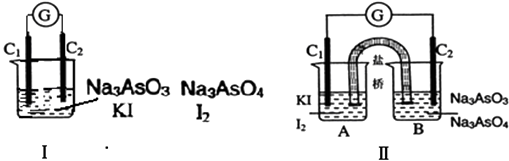
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置处理含NO3﹣的酸性工业废水,某电极反应式为2NO3﹣+12H++10e﹣=N2+6H2O,则下列说法错误的( ) 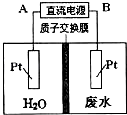
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6g N2 , 另一侧溶液质量减少l8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com