
��������HCl ��NaOH ��CH3COOH ��NH3��H2O ��CH3COONa ��NH4Cl ��C2H5OH ��SO2
��1������������ʵ��� ����Һ�ʼ��Ե��� ������ţ���
��2��������0.01 mol/L NaOH��Һ��pH= ��pH=11��CH3COONa��Һ����ˮ���������c(OH��) = ��
mol/L NaOH��Һ��pH= ��pH=11��CH3COONa��Һ����ˮ���������c(OH��) = ��
��3�������ӷ���ʽ��ʾCH3COONa��Һ�ʼ��Ե�ԭ�� ������Һ������Ũ�Ȱ��ɴ�С��˳��Ϊ ��
 ��4�������£���100 mL 0.01 mol��L��1HA��Һ��μ���0.02 mol��L��1MOH ��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ����ش��������⣺
��4�������£���100 mL 0.01 mol��L��1HA��Һ��μ���0.02 mol��L��1MOH ��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ����ش��������⣺
����ͼ����Ϣ��֪HAΪ_______��
���ǿ������������
���ڵμӹ����У�ˮ�ĵ���̶ȵı仯���� �� �����������С�����䡱��
��K���Ӧ����Һ�У� c(M��)��c(MOH)= mol��L��1��
��5����25 ���£���Ũ�Ⱦ�Ϊ0.01 mol��L��1��FeCl3��CuCl2�����Һ����μ��백ˮ��������__________����(�ѧʽ)���������ҺpH=11ʱ������¶��²�������Һ�е�c(Cu2+)��c(Fe3+)
= ��
����֪25��ʱKsp[Fe(OH)3]=4.0��10��38, Ksp[Cu(OH)2]=2.2��10��20��
��6��25��ʱ����bmol NH4NO3����ˮ�������Һ�μ�aL��ˮ����Һ�����ԣ������μӰ�ˮ��Ũ��Ϊ_______mol��L��1����NH3��H2O�ĵ���ƽ�ⳣ��ȡKb = 2��10��5 mol��L��1��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йص绯ѧ֪ʶ��������ȷ����
A��CaO��H2O== Ca(OH)2���Էų��������ȣ��ʿɰѸ÷�Ӧ��Ƴ�ԭ��أ������еĻ�ѧ��ת��Ϊ����
B��ijԭ��ط�ӦΪCu��2AgNO3===Cu(NO3)2��2Agװ���е������п�����װ�к�������KCl������Һ
C����Ϊ���Ļ�����ǿ��ͭ�����Խ�����ͭ�õ������Ӻ����Ũ�����У��������ԭ��أ���������������ͭ������
D��������˵���κ����Է����е�������ԭ��Ӧ������Ƴ�ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����������ȷ���ǣ� ��
A CO2ͨ������Թ�����������������������Թ��������С��̼��
B �������Ż�ȼ��ʱ������ĭ��������
C ���������ã����������������ױ���ʴ
D ������ˮPH����7�������PHС��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й��Ȼ�ѧ����ʽ�ı�ʾ��˵����ȷ���ǣ�
A����֪2H2(g)��O2(g)===2H2O(g)����H����483.6 kJ/mol��������
��ȼ����Ϊ241.8 kJ/mol
B��25 �桢101 kPaʱ��1 mol S��2 mol S��ȼ���Ȳ����
C����20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ����
�������ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��NaOH(aq)��
H2SO4(aq)=Na2SO4(aq)��H2O(l)����H����57.4 kJ/mol
D����֪I2(g)��H2(g)===2HI(g)����H1��I2(s)��H2(g)===2HI(g)����H2��
��H1>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ���й����ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�(����)
A��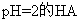 ��Һ��
��Һ��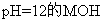 ��Һ�������ϣ�
��Һ�������ϣ�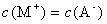
B��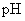 ��ȵ�
��ȵ�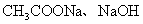 ��
��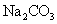 ������Һ��
������Һ��

C��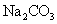 ��Һ��
��Һ��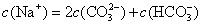
D�����ʵ���Ũ�����CH3COOH��CH3COONa��Һ�������ϣ�
c(CH3COO��) +2c(OH��) = 2c(H+) + c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ���������ж�Ԫ�ؽ�����ǿ�����ǣ� ��
A��1 mol���������ڷ�Ӧ��ʧȥ���ӵĶ���
B����������֮�䷢�����û���Ӧ
C������Ԫ������������Ӧ��ˮ����ļ���ǿ��
D������Ԫ�صĵ�����ˮ�����û������������׳̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������ȷ���ǣ� ��
A�������£�4 g CH4����NA��C��H���Թ��ۼ�
B��Һ̬��HCl���ܵ��磬����HCl���ڷǵ����
C����M����R2���ĺ�����Ӳ�ṹ��ͬ����ԭ��������R��M
D�����ӻ������в�һ���������Ӽ��������Թ��ۼ��Ļ����ﲻһ���ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б�ʾ��Ӧ��Ӧ�����ӷ���ʽ��ȷ����
A���ù���������ữ�ĺ����ҽ���Һ����ȡ�⣺2I��+H2O2+2H+==I2+2H2O
B����������Һ�еμӹ�����ˮ��Ag++NH3��H2O==AgOH��+NH4+
C��̼�����Ƶ�ˮ�⣺HCO3�� +H2O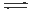 CO32�� +H3O+
CO32�� +H3O+
D���ö��Ե缫����Ȼ�þ��Һ��2Cl��+2H2O H2��+Cl2�� +2OH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com